粘合理论1-5
文献中对结合牢度,大多采用内聚力理论来描述。不过粘合理论至今还祗是概念性的。结合牢度不能通过计算,而应根据实测。我们将有关理论收集在一起,不加讨论,仅供读者参考。
一、粘合功和内聚功[1]
把两个本体相α和β的界面从它们的平衡位置可逆地分离到无穷远所需的功称为粘合功:
Wa=γα+γβ+γαβ (1)
式中Wa为粘合功;Yα和Yβ分别为α相和β相的表面张力, Yαβ为α相和β相之间的界面张力(见图1。2)。这一概念首先由Dupre’(杜普里) [5]提出。若两相相同,则可逆功即为内聚功:
Wcj=2γj
(2)
式中Wcj为第j相的内聚功.
粘合功等于两个单独的相相互靠近生成界面时单位面积上Gibbs(古布斯)自由能的减少值,因此,界面吸引越大,粘合功也越大。重排式(1-17),得
Yαβ=Yα+Yβ-Wa (3)
此式指出界面吸引力越大,界面张力就越小。从理论上可以把粘合功与内聚功相关联。因此,可能把界面张力与两个单独相的性质相关联(详见第二、三章)。
二、浸润与润湿[2]
(1)对基材表面进行必要的处理,用物理及化学的方法清除"薄弱界面层",并赋予适当的粗糙度。
在浸润、渗透的基础上,PU胶粘剂中极性基团及反应性基团还与各种基材发生物理及化学作用,因而形成粘接力。
(2)胶粘剂与被粘物分子间的接触,易使空气存留于界面上形成气泡(图2-5),从而导致胶接强度下降。
资料来源:粘接技术周明国著四川科技出版社1980P57
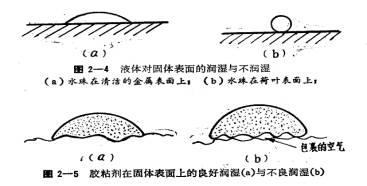
液体在固体表面上的润湿性能,以接触角θ这一数值表示是十分方便的。接触角θ是通过液滴三相(气、固、液三相)点作液滴曲面切线时,切线与液滴接触面一侧的夹角,如(图2-6)所示。

θ为0°表示固体表面被液体完全润湿; θ为180°(实际上不可能)相当于液体完全不润湿。一般应小于90°,越小越好。
三、物与物两者临界表面张力越接近越易亲近
金属及其氧化物、无机物的表面能都比较高(200-5000达因/厘米),而聚合物固体、胶粘剂、有机物、水等的表面张力比较低(<100达因/厘米=见表2-1和表2-2。
表2-1 一些聚合物的临界表面张力rc(20℃)[3][4]
|
聚合物 |
Yc(达因/厘米) |
|
脲醛树脂 |
61 |
|
纤维素 |
45 |
|
聚丙烯腈 |
44 |
|
聚氧化乙烯 |
43 |
|
聚对苯二甲酸乙二醇酯 |
43 |
|
尼龙66 |
42.5 |
|
尼龙6 |
42 |
|
聚砜 |
41 |
|
聚甲基丙烯酸甲酯 |
40 |
|
聚偏氯乙烯 |
40 |
|
聚氯乙烯 |
39 |
|
聚乙烯醇缩甲醛 |
38 |
|
氯磺化聚乙烯 |
37 |
|
聚醋酸乙烯酯 |
37 |
|
聚乙烯醇 |
37 |
|
聚苯乙烯 |
32.8 |
|
尼龙1010 |
32 |
|
聚丁二烯(顺式) |
32 |
|
聚乙烯 |
31 |
|
聚氨酯 |
29 |
|
聚氯化乙烯 |
28 |
|
聚乙烯醇缩丁醛 |
28 |
|
丁基橡胶 |
27 |
|
聚偏二氯乙烯 |
25 |
|
聚二甲基硅氧烷 |
24 |
|
聚三氟乙烯 |
22 |
|
硅橡胶 |
22 |
|
聚四氟乙烯 |
18.5 |
|
聚全氟丙烯 |
16.2 |
|
聚甲基丙烯酸全氟辛酯 |
10.6 |
表2-2常用粘合剂的表面张力[5][6]
|
粘合剂 |
在20℃时的表面张力rL(达因/厘米) |
|
酚醛(酸固化物) |
78 |
|
水 |
72.8 |
|
糠醛胶 |
71 |
|
间苯二酚-甲醛树脂 |
71 |
|
苯酚-间苯二酚-甲醛胶 |
52 |
|
间苯二酚甲醛胶 |
51 |
|
脲醛树脂 |
48 |
|
酪朊粘合剂 |
47 |
|
环氧树脂* |
47 |
|
特殊环氧胶 |
45 |
|
动物胶 |
43 |
|
聚醋酸乙烯酯乳液 |
38 |
|
天然橡胶。松香胶 |
36 |
|
环氧树脂** |
30 |
|
硝化纤维素 |
26 |
注:*通用环氧树脂,**未加说明
浸润性主要决定于胶粘剂和被粘物的表面张力,还与工艺条件、环境因素等有关。
四、粘接力
胶粘剂对被粘物的浸润只是粘接的前提,必须能够形成粘接力才能达到粘接的目的。
表1-13 不同结合的原子间距离与键能的关系[7]
|
结合种类 |
原子间距离(Å) |
键能(千卡/克分子) |
|
化学力(共价键)* |
1-2 |
50-200 |
|
氢键力** |
2-3 |
3-10 |
|
次价力 |
3-5 |
0-2 |
注:*化学力即主价力,按键的形式可分为离子键、共价键、金属键三类。表中列出了处于这三类键中具有中等键能的共价键的数值。
**在有些文献上将氢键包括在次价力中
五、氢键[8]
氢键的强弱与原子A与B的电负性大小有关,A、B的电负性越大,则氢键越强;另外也与原子B的半径大小有关,即原子B的半径越小别越容易接近H—A中的氢原子,因此氢键越强,例如,氟原子的电负性最大而半径很小,所以氢键中的F—H…F是最强的氢控。在F—H、O—H、K—H、C—H系列中,形成氢键的能力随着与氢原仍B结合的原子的电负吐的降低而递降。碳原子的电负性很小,C-
H一般不能形成氢键,但在M—C≡N或H-CCl3等中,由于氮原子和氯原子的影响,使碳原子的电负性增大,这时也可以形成氢链。例如,HCN的分子之间可以生成氢键,三氯甲烷和丙酮之间也能生成氢键;
氢键的键长是指原子A到原子B之间的距离。它比范德华半径之和要小,但比共价半径之和大很多。例如甲酸分子之间的氢键,两个氧原子之间的距离为o.267nm.而范德华半径之和约为0.35nm,共价半径之和为0.162nm,单体甲酸分子中的O一H键长为0.098nm,其二聚体的O—H键长为0.104nm,O—H…O键长为0.267nm,因此形成氢键以后O—H键长发生了变化。H…O键的键长为0.163nm,要长于O—H键的键长。
表 一些常见氢键的键长与键能
|
氢键 |
化合物 |
键长(nm) |
键能(Kj/mol-1) |
|
F-H…F |
(HF) |
0.255 |
28.1 |
|
O-H…O |
水 |
0.276 |
18.8 |
|
(HCOOH)2 |
0.267 |
29.3 |
|
|
(CH3COOH)2 |
- |
34.3 |
|
|
NaHCO3 |
0.255 |
- |
|
|
N-H…F |
NH4F |
0.268 |
20.9 |
|
N-H…N |
NH3 |
0.338 |
5.4 |
|
O-H…Cl |
邻氯苯酚(气) |
- |
16.3 |
|
N-H…Cl |
NH2NH2·2HCl |
0.310 |
- |
|
C-H…N |
(HCN) 3 |
- |
18.3 |
|
(HCN) 2 |
- |
13.7 |
氢键A—H…B的键能,由静电作用能、离位能以及诱导能和色散能三部分构成。
酰胺(RCONH2)和N—取代酰胺(RCONHR’)分子中氮原子上都有氢原子,都能形成分子间氢键,前者能力更强些。酰胺晶体中N—H…O距离的数值(平均值)为2.93nm。N,N-二取代酰胺(RCONR’R’’)氮原于上没有氢原子,不能形成分子间氢键。
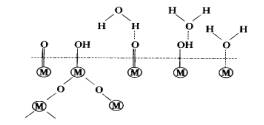
六、金属、玻璃、陶瓷等的粘接[10]
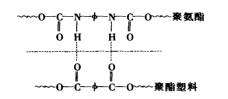
金属、玻璃等物质表面张力很高,属于高能表面,在PU胶粘剂固化物中含有内聚能较高的氨酯键和脲键,在一定条件下能在粘接面上聚集,形成高表面张力胶粘层。一般来说,胶粘剂中异氰酸酯或其衍生物百分含量越高,胶粘层的表面张力越大,胶越坚韧,能与金属等基材很好地匹配,粘接强度一般较高。
含-NCO基团的胶粘剂对金属的粘接机理如下:
金属表面一般存在着吸附水(即使经过打磨处理的金属表面也存在微量的吸附水或金属氧化物水合物),-NCO与水反应生成的脲键与金属氧化物之间由于氢键而整合形成酰脲-金属氧化物络合物,-NCO基团还能与金属水合物形成共价键等。
在无-NCO场合,金属表面水合物及金属原子与氨酯键及脲键之间产生范德华力和氢键,并且以TDI、MDI为基础的聚氨酯胶粘剂含苯环,具有π电子体系,能与金属形成配价键。金属表面成分较为复杂,与PU胶之间形成的各种化学键或次价键(如氢键)的类型也很复杂,图2-11为前人提出的金属表面价键结构模型和粘接机理。
|
|
|
金属表面模型 |
|
|
|
PU金属界面键合模型 图2-11金属表面与聚氨酯键合模型 |
玻璃、石板、陶瓷等无机材料一般由Al2O3、SiO2、CaO和Na2O等成分构成,表面也含吸附水、羟基,粘接机理大致与金属相同。
七、塑料、橡胶的粘接[2]
橡胶的粘接一般选用多异氰酸酯胶粘剂或橡胶类胶粘剂改性的多异氰酸酯胶粘剂,胶粘剂中所含的有机溶剂能使橡胶表面溶胀,多异氰酸酯胶粘剂分子量较小,可渗入橡胶表层内部,与橡胶中存在的活性氢反应,形成共价键。多异氰酸酯还会与潮气反应生成脲基或缩二脲,并且在加热固化时异氰酸酯会发生自聚,形成交联结构,与橡胶分子交联网络形成聚合物交联互穿网络(IPN),因而胶粘层具有良好的物理性能。用普通的聚氨酯胶粘剂粘接橡胶时,由于各材料基团之间的化学及物理作用,也能产生良好的粘接。
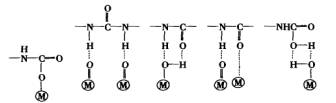
PVC、PET、FRP等塑料表面的极性基团能与胶粘剂中的氨酯键、酯键、醚键等基团形成氢键,形成有一定粘接强度的接头。图2-12为PU胶粘剂层与含酯基的塑料(如PET薄膜、FRP)之间胶粘界面示意图。
|
|
|
图2-12 PU/FRP(或PET)界面形成氢键示意图 |
有人认为玻纤增强塑料(FRP)中含-OH基团,其中表面的OH与PU胶粘剂中的-NCO反应形成化学粘接力。
非极性塑料如PE、PP,其表面能很低,用极性的聚氨酯胶粘剂粘接时可能遇到困难,这可用多种方法对聚烯烃塑料进行表面处理加以解决。-种办法是用电晕处理,使其表面氧化,增加极性:
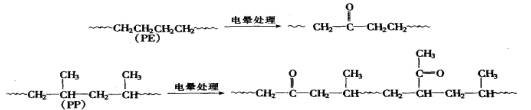
另-种办法是在被粘的塑料表面上采用多异氰酸酯胶粘剂等作增粘涂层剂(底涂剂、底胶)。如熔融PE挤出薄膜在PET等塑料薄膜上进行挤出复合时,由于PE表面存在低聚合度的弱界面层,粘接强度不理想,使用底胶时,多异氰酸酯在热的聚乙烯表面上扩散,使弱界面层强化,复合薄膜则具有非常好的剥离强度。
八、织物粘接[2]
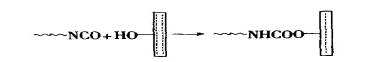
织物由纤维组成,而纤维具有-定的吸湿率,并且常含有醚键、酯键、酰胺键等极性键,以及羧基、羟基等。水和烃基容易与PU胶粘剂中-NCO基团反应,形成牢固的氨酯键和脲键等化学键,而纤维中的极性基团与胶中的极性基团之间形成氢键,并且胶粘剂分子还容易渗人纤维之间。PU对于这类材料-般能形成牢固的粘接。
九、胶粘剂与颜料的结合牢度
涂料印花的色牢度取决于涂料粘合剂对颜料的包容和粘结牢度,颜料是由有色体经‘颜料化’制备而成,大小为0.1-0.5µm的初级粒子,用溶剂或表面活性剂润湿,并聚集成为松散的稳定的二级粒子(0.5-10µm),将松散粒子通过研磨,使细度达到1µm以下。有的颜料需要用添加剂来抑制储存中晶体的生长、聚集,最重要的添加剂是松香酸衍生物(松香酸或其碱土金属盐)、脂肪胺、酰胺。
用高分子聚合物进行表面处理几乎适用於一切有机颜料。处理方法;可以将颜料、聚合物单体和分散介质相混合,研磨并加入聚合引发剂,这种方法称为‘原位聚合’(insitu polymerization)所得的涂料(polymer coated pigment)是一种以颜料为核心,高聚物为外壳的包核产品,耐光耐氧气化性都比较好[9]。涂料印花色牢度,除了与涂料粘合剂本身的耐水性是一个因素以外,研究颜料包壳与粘合剂的结合牢度也是一个重要方面。
参考文献
[1]《高聚物的界面与粘合》[美]S.吴著
潘强余 吴敦汉译纺织工业出版社1987/12
[2]《聚氨酯胶粘剂》李绍雄
刘益军p33
[3]《实用粘接手册》李子东编著P364(1986)
[4]《粘合剂及其应用》汪锡安
胡宁先P28
[5]《实用粘接手册》李子东编著P364(1986)
[6]《粘合剂及其应用》汪锡安
胡宁先P28
[7]《粘合剂及其应用》江锡安
胡宁先编P31
[8]《有机化学中的氢键问题》王庆文 杨玉桓 高鸿宾1993/12;243
[9]《有机颜料》莫述城 陈洪 施印华 编著1986.4;55-84]