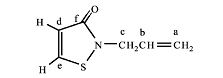含不饱和侧链异噻唑类抗菌剂的合成及其抗菌性能初步评价Zj-20111014-1
衡士芳1 , 刘霞1 , 杨月1 , 陈小斌1 , 刘振东1, 2 ( 1、北京服装学院材料科学与工程学院, 北京 100029; 2、北京服装学院北京市服装材料研发与评价重点实验室, 北京100029
收稿日期:2008- 10- 21 修回日期:2009-05-16
基金项目:北京市教委面上项目( KM200810012006)
作者简介: 衡士芳( 1981- ) , 女, 硕士生。研究方向为功能性纺织助剂的合成及其应用。刘振东, 通讯作者, E-mail: bictlzd@tom. com。
原载:纺织学报2009/9;87-92
【摘要】针对小分子有机抗菌剂存在耐热性差、基体相容性不好、渗出物安全性差等问题, 设计合成用于高分子类抗菌剂的含有不饱和侧链的异噻唑类化合物。以3-巯基丙酸甲酯为原料, 经氨解、关环、烯丙基化合成了2 种含有不饱和侧链的异噻唑类化合物, 分别为3-烯丙氧基异噻唑和N-烯丙基异噻唑啉酮。通过电子轰击质谱、核磁共振氢谱和碳谱对其产物及关键中间体的结构进行表征。2 种含有不饱和侧链异噻唑类化合物的总收率达52%, 优化后的合成路线条件温和, 操作简单, 易于控制。抗菌性能初步评价结果显示, 2 种异噻唑类化合物都具有良好的杀菌性能。
【关键词】合成; 异噻唑啉酮; 抗菌; 表征
【中图分类号】TQ 463 文献标志码: A 文章编号: 0253-9721(2009) 09-0087-06
异噻唑啉酮是具有高效广谱杀菌性能的一类化合物[1] , 具有配伍性好, 能在较广的pH 值范围内保持较强活性杀菌力等优点, 更重要的是对环境安全,符合环保抗菌剂的发展趋势[2]。最早的异噻唑啉酮类杀菌防腐剂商品由美国ROHM&HASS 公司于1975年开发成功, 并于1992 年取得商品代号为KATHON系列产品的专利权[3]。目前, 此类抗菌剂在发达国家已得到普遍的应用, 国内对此类抗菌剂的研究始于20 世纪90 年代后期。为了得到高效、耐久、加工方便的抗菌纺织品, 合成具有可聚合或通过接枝引入抗菌官能团而获得抗菌性能的抗菌材料具有一定的实际意义[4]。这类抗菌材料克服了普通有机抗菌剂耐热性差、基体相容性不好、渗出物安全性差等缺点, 具有高效广谱、安全无毒、抗菌效果持久等特点。虽然纺织行业对其研究还处于刚刚起步的阶段, 但应用前景非常广阔。
以异噻唑啉酮为基本抗菌单元, 通过相关文献方法[ 5- 9] 进行改进, 尝试开发工艺简单、高效的新型合成工艺, 并以此类化合物为基本母体与高分子形成抗菌高分子, 以扩大其应用领域, 提升其使用价值。
本文以3-巯基丙酸甲酯为起始原料, 经氨解、环化和烯丙基化制备异噻唑啉-3-酮, 并在碱催化下与烯丙基溴反应制备烯丙基异噻唑化合物。在此方法中, 反应所需试剂均易得且价格便宜, 整个反应在常压下进行, 反应条件温和, 更便于工业化。
1 实验部分
1.1 试剂与仪器
试剂: 3-巯基丙酸甲酯, 工业品, 北京偶合科技有限公司; 磺酰氯, 化学纯, 上海金山亭新化工试剂厂; 乙酸乙酯, 化学纯, 北京新光化学试剂厂; 二氯甲烷, 化学纯, 北京新光化学试剂厂; 氨水, 分析纯, 北京益利精细化学试剂厂; 烯丙基溴, 化学纯, 北京化学试剂公司; 氢氧化钾, 分析纯, 北京化工厂。
仪器: Bruker AV400 核磁共振谱仪, 德国布鲁克公司; Heidolph Laborota4000 旋转蒸发仪, 德国Heidolph 公司; 5973 电子轰击质谱仪, 美国安捷伦公司。
1.2 中间体及目标产物的合成
1.2.1 3-巯基丙酰胺的合成
在装有温度计和球形冷凝管的250 mL三口瓶中, 加入24 g( 0.2 mol) 3-巯基丙酸甲酯, 10℃以下一次性加入氨水119.6 mL( 1.6 mol) , 在此温度下反应2 h, 升至室温(约20 ℃) 继续反应6 h, 反应液用旋转蒸发仪浓缩, 静置冷却, 得白色片状晶体, 抽滤干燥。产率为86.4%, 熔点为99.7~ 100.1 (文献[10]介绍的熔点为98 ~ 100 ℃)。1H-NMR ( CDCl3 ,400 MHz) δ: 1.6( t, 1H, SH) , 2.5 ( t , 2H, CH2 ) , 2.7 ~2.8( m, 2H, CH2 ) , 5.6~ 5.9( d, 2H, NH2 ) 。
1.2.2 异噻唑啉-3-酮的合成
在装有温度计、滴液漏斗及球形冷凝管的250 mL三口瓶中, 加入4 g( 0.038 mol) 3-巯基丙酰胺、70 mL二氯甲烷, 搅拌下滴加磺酰氯( 0.08 mol) , 滴完后继续反应2 h, 冷却、抽滤得白色粉末, 将其用水溶解后在搅拌下滴加氨水, 直到pH 值为8 左右, 用旋转蒸发仪蒸干, 乙酸乙酯重结晶, 抽滤得2.9 g 浅黄色固体, 产率为75.3% , 熔点为70.0~ 70.5℃(文献[11] 介绍的熔点为75~76℃。将反应后抽滤所得滤液在低温下静置数小时, 将析出物抽滤得白色针状晶体为0.14 g, 即5-氯异噻唑啉-3-酮, 收率为2.7%, 熔点为91.1~ 92.0 (文献[12]介绍的熔点为96~ 97℃)。1H-NMR( CDCl3 , 400MHz)δ: 6.5( d,1H, CH) , 8.4( d, 1H, CH) , 11.5 ( broad, 1H, NH) ; EI-MS, m/z: 101(M. + ) 。
1.2.3 烯丙基异噻唑的合成
在100 mL三口瓶中, 放入4 g ( 0.04 mol ) 异噻唑啉-3-酮并用17 mL乙醇溶解, 称取2.8 g ( 0.04 mol)KOH 放入三口瓶中, 搅拌数分钟后, 室温下滴加4.1 mL( 0.048 mol ) 烯丙基溴, TLC 监测反应进程。反应4 h停止搅拌, 将反应液进行抽滤。产品用硅胶柱层析方法进行分离, N烯丙基异噻唑啉酮为2.5 g, 收率为44.8% ; 3-烯丙氧基异噻唑为2 g, 收率为35.8%(文献[9]为26% )。均为浅黄色液体。
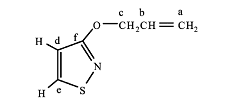
N-烯丙基异噻唑啉酮: 1H-NMR ( CDCl3 ,400MHz)δ: 4.3( t , 2H, c) , 5.2~ 5.3( m, 2H, a) , 5.8(m, 1H, b) , 6.2 ( d, 1H, d) , 8.0( d, 1H, e) ;C-NMR( CDCl3 , 400 MHz)δ: 45.9( c) , 114.4 ( b) , 119.2( a) ,132.6( d) , 139.6( e) , 168.6( f) ; m/z: 141(M. + ) 。
3-烯丙氧基异噻唑: 1H-NMR ( CDCl3 , 400MHz)δ: 4.8( d, 2H, c) , 5.2~ 5.3( m, 2H, a) , 6.0( m, 1H, b) ,6.6( d, 1H, d ) , 8.4 ( d, 1H, e ) ; 13C-NM R ( CDCl3 ,400MHz)δ: 69.3 ( c ) , 111.89 ( b) , 118.0( a) , 132.9( d) , 148.7( e) , 169.2( f) ; m/z: 141( M. + ) 。
1.2.4 含不饱和侧链异噻唑抗菌性测定
分别从事先配制好的质量浓度为10、1、0.1、0.01 g/L的溶液中取20 mL, 放入250 mL的锥形瓶内,用移液枪移取1 mL接种菌悬液分别放到锥形瓶中,充分摇晃并用棉塞塞紧, 放入恒温培养箱培养24 h。分别向锥形瓶中加入100 mL经提前高温杀菌的磷酸盐缓冲溶液( PBS) , 充分振荡。用移液枪分别吸取1 mL培养液, 用10 倍稀释法对培养液进行稀释, 从各个稀释度的试管中每次吸取1 mL, 分别放入到2个培养皿中。在培养皿中加入温度为45~ 46 的营养琼脂培养基约15 mL, 在室温下凝固。倒置平皿, 放入培养箱里培养, 温度为( 37 ± 1)℃, 24 h后取出计数。为降低误差, 对同一试样至少作3 次平行测试, 取其平均值计算抑菌率[13]。
2 结果与讨论
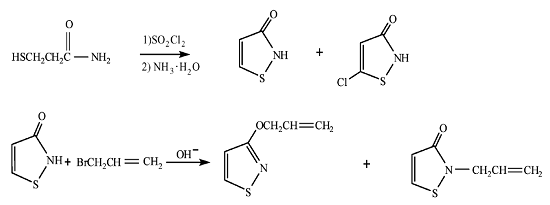
在查阅文献的基础上, 本文提出了以巯基丙酸甲酯为起始原料的合成路线, 见图1。
2.1.3 巯基丙酰胺的合成与表征
2.1.1.3 巯基丙酰胺的合成
有关3-巯基丙酰胺合成方法的文献报道主要有3 类: 1) 丙烯酰胺与硫代乙酸在水中反应[14] , 然后加入NaOCH3 用HCl中和, 收率为55.4% 。此方法所
|
|
|
图1 含有不饱和侧链的异噻唑的合成 |
用的硫代乙酸较昂贵, 产品收率较低; 2) 丙烯酰胺与硫化氢在80 ~ 90 , 6~ 7MPa 下反应[10] , 收率为73.3%。此方法的产品收率较方法1 有所提高, 但整个反应需在高压下进行, 对所需设备要求严格; 3)硫化钠与丙烯酰胺在20℃反应[ 10] , 用盐酸中和, 收率为84.1%。此方法所得产品收率较前2 种方法都有显著提高, 不足之处在于反应中所用的CS2 在后期处理阶段很难回收, 易造成环境污染。
鉴于以上路线的不足, 本文实验从氨解反应出发, 用3-巯基丙酸甲酯与氨水反应合成3-巯基丙酰胺, 此方法操作简单, 收率为86.4%。整个实验过程用薄层色谱进行监测, 分别从反应物物质的量比n ( 3-巯基丙酸甲酯) : n(氨水) ( nA :nB )、反应时间、反应温度3 方面展开实验, 对实验条件进行优化, 实验结果见表1~ 3。
从表1 可以看出, 氨解反应收率随着反应物物质的量比的增大而增加, 当反应物物质的量比为1:8 时最高, 但大于1:8 后, 能与氨发生反应的官能团达到饱和, 氨水的加入不再使氨有效浓度增加。从表2 可以看出, 当反应时间大于9 h后, 时间对收率的影响并不显著。表3 数据表明, 当反应温度超过20℃后, 产品的收率呈现下降趋势。主要原因在于温度升高后, 参与反应的氨水受热分解, 致使体系中氨的有效浓度降低, 收率下降, 因此, 合成3-巯基丙酰胺的最佳条件为: 3-巯基丙酸甲酯与氨水的物质
表1 反应物物质的量比对收率的影响
|
n A:nB |
收率/% |
nA:n B |
收率/% |
|
1:4 |
26.0 |
1:8 |
85.2 |
|
1:6 |
70.0 |
1:10 |
72.5 |
注: 反应在室温(约20℃) 下进行, 反应时间为8 h。
表2 反应时间对收率的影响
|
反应时间/h |
收率/% |
反应时间/h |
收率/% |
|
6 |
80.5 |
11 |
85.5 |
|
9 |
85.3 |
13 |
86.0 |
注: n A:nB= 1:8, 室温(约20℃)下进行。
表3 反应温度对收率的影响
|
反应温度℃ |
收率/% |
反应温度℃ |
收率/% |
|
10 |
79. 0 |
35 |
83.3 |
|
20 |
86.4 |
40 |
80.5 |
注: n A:nB= 1:8, 反应时间为8 h。
的量比1:8, 在10℃以下反应2 h, 然后升至室内温度( 20℃) 反应8 h, 收率为86.4%。
2.1.2 3-巯基丙酰胺的表征
核磁氢谱中所呈现出的H 的个数与理论值一致, 化学位移值在5.6~ 5.9 处出现的2 个较宽的峰为NH2 上H 的特征峰, 由此可以推断, 在反应过程中巯基丙酸甲酯与氨水确实发生了氨解反应。
2.2 异噻唑啉3酮的合成与表征
2.2.1 异噻唑啉3酮的合成
采用磺酰氯(C)与3-巯基丙酰胺(D) 反应制备异噻唑啉-3-酮, 分别对反应溶剂种类、磺酰氯与3-巯基丙酰胺的物质的量比nc:nD 对反应的影响进行讨论。
2.2.1.1 不同溶剂对收率的影响
反应中采用的溶剂分别为二氯乙烷、二氯甲烷、三氯甲烷, 对应的收率依次为42.9%、62.8% 、48.1% ( nC:nD= 2.1:1,溶剂量为100 mL, 温度为38℃, 时间为7 h(滴加完毕继续反应1 h) ) 。
参考专利[15] , 采用卤代烷烃作为反应溶剂是比较适宜的, 反应采用薄层色谱进行监控。从实验结果可以看出, 用二氯甲烷做溶剂收率最高。从实验现象来看, 在3 组实验中, 二氯甲烷做溶剂时反应所得产物颜色最好, 为乳白色, 其他2 组均为黄色, 因此,确定二氯甲烷为反应溶剂。
2.2.1.2 反应物物质的量比对收率的影响
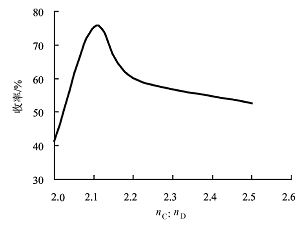
图2 示出异噻唑啉-3-酮的收率与反应物物质的量比的关系曲线。
|
|
|
图2 异噻唑啉3 酮收率与反应物的物质的量比( nC: nD) 的曲线图 |
反应条件: 溶剂量为100 mL; 温度为38 ℃; 时间为7 h( 滴加完毕继续反应1 h) , 溶剂为二氯甲烷。
由图2 可以看出, 随着磺酰氯( C) 与3-巯基丙酰胺(D) 物质的量比增加, 异噻唑啉3酮的收率呈现上升的趋势, 当反应物的物质的量比超过2.1:1 时收率开始下降。这是因为在反应过程中, 每个分子的关环产物需要2 个分子的磺酰氯, 因此, 当磺酰氯加入量超过2 倍量时, 将导致副产物5-氯异噻唑啉-3-酮的生成量逐渐上升。由此可以看出, 反应物的物质的量比对异噻唑啉-3-酮的产率有很大的影响,反应最佳物质的量比为2.1 :1, 所得产品通过1H-NMR、EI-MS 进行了结构表征。
2.2.2 异噻唑啉3酮的结构表征
从1.2.2 中列出的物质结构信息, 可推断反应过程中关环生成了异噻唑啉-3-酮。
2.3 含不饱和侧链异噻唑的合成与表征
2.3.1 含不饱和侧链异噻唑的合成
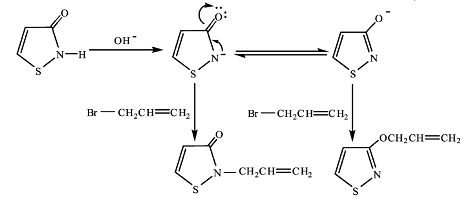
在专利[9]中有关3-烯丙氧基异噻唑的合成, 所报道的方法采用的是DMF 和NaH 反应体系, 该反应体系的溶剂回收困难, 易造成环境污染; 所用强碱NaH 易燃易爆, 要求反应在无水条件下进行, 易变质, 难于保存; 产品3-烯丙氧基异噻唑收率较低, 只有26%。本文采用的是无水乙醇和KOH 反应体系。KOH 价格低廉, 反应溶剂无水乙醇不存在环境污染问题, 在反应的后处理阶段只需用旋转蒸发仪将溶剂蒸干, 即可用柱层析的方法进行提纯。实验得到了2 种含不饱和侧链的异噻唑类化合物: 3-烯丙氧基异噻唑(收率为35.8%) 和N-烯丙基异噻唑啉酮(收率为44.8%)。从反应物异噻唑啉-3-酮的结构上看, 它是烯醇式结构和酮式结构并存的一组同分异构体, 酮式烯醇式互变异构现象在羰基化合物中普遍存在, 它可被酸碱所催化, 本文涉及的主要是碱催化下的烯丙基化反应, 反应机制见图3。
|
|
|
图3 碱催化下烯丙基化反应机制 |
2.3.2 含不饱和侧链异噻唑的结构表征
N-烯丙基异噻唑啉酮和3-烯丙氧基异噻唑的结构示意图见图4、5。
|
|
|
|
图4 N-烯丙基异噻唑啉酮结构 |
图5 3-烯丙氧基异噻唑结构 |
通过分析这2 种化合物的结构表征数据可以得知, 2 种化合物的分子质量与理论值相符, 均为141,核磁氢谱图所统计的氢的个数与理论值一致, 但从核磁碳谱中可以明显看出这2 种物质在结构上的差别, 化学位移值δ分别为45.9 和69.3 处的碳峰为烯丙基与N 连接的亚甲基碳和与O 连接的亚甲基碳。由此可以证明, 在本文的实验条件下得到了2 种含不饱和侧链的异噻唑类化合物, 即3-烯丙氧基异噻唑和N-烯丙基异噻唑啉酮。
2.4 含不饱和侧链异噻唑的抗菌性评价
根据1.2.4 的操作方法进行实验, 采用的菌种为大肠杆菌, 结果见表4。
表4 异噻唑类抗菌剂在不同质量浓度下的抑菌率
|
抗菌剂种类 |
质量浓度/( g/L) |
菌落个数 |
抑菌率/% |
|
N-烯丙基异噻唑啉酮 |
10.00 |
0 |
100.0 |
|
1.00 |
0 |
100.0 |
|
|
0.10 |
79 |
70.6 |
|
|
0.01 |
175 |
34.9 |
|
|
3/烯丙氧基异噻唑 |
10.00 |
0 |
100.0 |
|
1.00 |
0 |
100.0 |
|
|
0.10 |
92 |
65.8 |
|
|
0.01 |
205 |
23.8 |
|
|
空白 |
269 |
/ |
|
从表4 可以看出, 随着抗菌剂质量浓度的降低,2 种异噻唑类抗菌剂抑菌率都呈现下降的趋势, 当质量浓度范围在0.1~ 10 g/L时, 对大肠杆菌均显现出优良的杀菌性能; 当质量浓度处于0.01~ 0.1 g/L时, 也表现出一定的杀菌特性。
3 结论
1) 本文通过改进实验路线, 以3-巯基丙酸甲酯为原料, 经氨解、关环、烯丙基化反应合成了2 种含不饱和侧链的异噻唑类化合物, 即N-烯丙基异噻唑啉酮和3-烯丙氧基异噻唑, 这2 种异噻唑类化合物是合成一类新型抗菌高分子的关键单体。
2) 优化后的反应条件具有路线简单、原料易得、条件温和且易于控制及环保的特点, 2 种含烯丙基侧链化合物的总收率达到52%。
3) 通过对2 种含不饱和侧链异噻唑抗菌剂的初步抗菌性测定发现, 2 种含不饱和侧链的异噻唑类化合物都具有优良的杀菌性能。
参考文献:
[1] 齐登谷. 异噻唑啉酮杀菌剂[ J] 工业水处理, 1995,15( 2) : 9- 11.
[2] 贺永宁, 许风铃, 林强. 异噻唑啉酮类化合物的应用研究进展[ J] 上海涂料, 2007, 45( 6) : 25- 27.
[3] DERBYSHIRE R L, WILLINGHAM G L. Use of hydrazide stabilizers for 3isothiazolones: US, A01N, 5118699[ P] .1992- 06- 02.
[4] 张葵花, 林松柏, 谭绍早. 有机抗菌剂的研究及发展现状[ J] . 涂料工业, 2005, 35( 5) : 45- 49.
[5] 王贤丰, 杨建平, 邬宁昆, 等. N, N-二正辛基-3, 3-二硫代二丙酰胺的合成[ J] . 农药, 2006, 45( 10) : 669-671.
[6] LAW A B, LEWIS S N, MILLER G A. Certain 2-Carbamoyl-3-isothizaorlenes: US, A01N, 3523121 [ P] 1970- 08- 04.
[7] 徐卫国, 陈勇. 2-甲基-4-异噻唑啉-3-酮及其衍生物5-氯-2甲基-4-异噻唑啉-3-酮的合成[ J] . 浙江化工,2001, 32( 2) : 55- 57.
[8] 李淑琏, 谭小青. 新型工业杀菌剂异噻唑啉酮类包合物的合成研究[ J] . 精细化工, 1999, 16( 1) : 4- 6
[9] LEWIS S N, MILLER G A. Certain 3-alkoxyisothiazole-4-carboxylic acids and derivatives thereof: US, A01N,4053479[ P] . 1977- 10- 11.
[10] 中滨哲郎, 高柳恭之. 3-巯基丙酰胺衍生物的制备方法: 日本, 59098047[ P] . 1984- 06- 06.
[11] LEWIS S N, MILLER G A. Process for the preparation of 3-isothiazolones and 3-hydroxy-isothiazoles: US, A01N,3849430[ P] . 1974- 11- 19.
[12] KHALAJ A, ADIBPOUR N, SHAHVERDI A R, et al.Synthesis and antibacterial activity of 2( 4substituted phenyl)3 ( 2H )isothiazolones [ J ] . European Journal of Medicinal Chemistry, 2004( 39) : 699- 705.
[13] 季君晖, 史维明. 抗菌材料[M] 北京: 化学工业出版社, 2003: 66- 68.
[14] LUTTRINGHAUS A, SCHNEIDER R. Preparation of isothiazolones [ J] . Liebigs Ann Chem, 1964 ( 679 ) :123- 135.
[15] WELLER E D, PA A. Isothiazolidin3ones: US, A01N,4169949[ P] . 1979- 10- 02.