固定化蛋白酶的制备及其在毛织物中的应用
钟业桂1,2,葛凤燕1,2,蔡再生2,1 1.纺织面料技术教育部重点实验室,东华大学,2. 东华大学化学化工与生物工程学院
原载: 上海印染新技术交流研讨会论文集(2009年度);372-376
稿件来源:sh9-372
【摘要】以壳聚糖微球为载体,戊二醛为交联剂,制备纺织用固定化蛋白酶,考察固定化蛋白酶的最佳制备条件及其稳定性,并将其应用于毛织物抗起毛起球整理中。结果表明,戊二醛浓度为1.0%,交联时间为5h,酶与载体质量比为40mg/g,制备的固定化蛋白酶的固载率为84.4%,酶活回收率可达57.2%。与游离酶相比,固定化蛋白酶的耐酸碱稳定性、热稳定性与储存稳定性均有所提高,且可循环使用。将制备的固定化蛋白酶用于羊毛织物的抗起毛起球整理中,其抗起毛起球等级提高1.5级。
前 言
在对环保、节能要求越来越高的今天,纺织用酶制剂因其具有高效、低能耗,废液易生物降解,符合生态要求的优点,在纺织印整领域中的应用越来越广泛。由于纺织加工所用酶反应都是在生物体外进行,周围环境因素极易影响到酶的活力,从而对加工过程工艺条件要求非常严格。如何提高酶活力、酶的稳定性能,有利于实现其在印染加工中的工业化生产,这是一个急于解决的问题。酶的固定化技术是解决该问题的一种有效方法。虽然酶的固定化技术在生物医药、食品等领域已有应用,但在印染整理中的应用却鲜为报道。由此可见,研究固定化酶剂在印染整理中的应用具有重要的理论和实际意义。
本实验选用壳聚糖作为载体,制备纺织用固定化蛋白酶,探讨了蛋白酶的最佳固定化条件及其酸碱稳定性、热稳定性和储存稳定性,并将其应用于羊毛织物抗起毛起球整理,评定其效果。
1 实验材料与方法
1.1 实验材料与仪器
羊毛针织物 50支双股毛纱织制,纬编平针织物,自织。
药品 壳聚糖(脱乙酰度≥90%,国药集团化学试剂有限公司);Savinaze 16 L蛋白酶(诺维信(中国)投资有限公司);戊二醛溶液(25%)(国药集团化学试剂有限公司);其他试剂:市售,生化试剂或分析纯。
仪器
DZG-6021型真空干燥箱(上海森信实验仪器有限公司);L80-2型离心沉淀机(上海跃进医疗器械厂);UV-2000型紫外可见分光光度计(尤尼科(上海)仪器有限公司)。
1.2 实验方法
1.2.1 壳聚糖微球的制备
称取一定量壳聚糖,加入到2.0%(v/v)的醋酸溶液中,充分搅拌,配成浓度为5.0%(w/v)的壳聚糖胶体溶液。在磁力搅拌下,将壳聚糖胶体溶液逐滴加入到一定浓度的NaOH溶液中,得到白色颗粒状壳聚糖微球。用去离子水把颗粒洗至中性,抽滤,真空干燥后备用。
1.2.2 固定化蛋白酶的制备
取1g壳聚糖微球,置于25ml一定浓度的戊二醛溶液中,于35℃水浴中处理5h。用去离子水洗去多余的戊二醛,即得活化后的壳聚糖微球载体。
将活化后的载体加入到用适宜的pH值缓冲溶液稀释的蛋白酶液中,置于一定温度水浴中振荡30min后,于4℃冰箱中固定化反应16h。取出,抽滤,洗掉未固定的游离酶,于35℃下真空干燥,即得壳聚糖微球固定化蛋白酶。
1.2.3 蛋白酶活力的测定
游离蛋白酶活力的测定方法按照参考文献1附录四进行;固定化蛋白酶活力测定方法同游离酶,将1ml游离酶换成1g固定化酶即可。
蛋白酶活力单位的定义:40℃、最适pH值条件下,每μml酶液(每mg固定化酶)每分钟催化酪蛋白水解生成1μg酪氨酸定义为一个酶活单位。
|
固载率= |
加入酶的总活力 - 未固定酶的活力 |
×100% (公式1) |
|
加入酶的总活力 |
|
酶活回收率= |
固定酶的活力 |
×100% (公式2) |
|
加入酶的总活力 - 未固定酶的活力 |
|
酶活桎百分比= |
某一条件下测定的酶活力 |
×100% (公式3) |
|
该系列条件下最高的酶活力 |
1.2.4 羊毛织物抗起毛起球整理
织物预处理 试样按浴比1:20,在30%H2O260ml/L,水玻璃4.5g/L,JFC 1.0g/L,pH=8.5-9的溶液中,50℃恒温处理60min。取出水洗,烘干。
织物抗起毛起球整理 分别取一定量游离蛋白酶与固定化蛋白酶,使酶含量达到羊毛织物重的2%,于各自最适pH值缓冲溶液中,40℃恒温水浴处理30min后,取出水洗,烘干。
1.2.5 整理性能测试
起毛起球性能 参照GB/T 4802.2-1997,采用Nu-Martindale 864型耐磨及起毛起球试验仪(英国JAMES H. HEAL公司)测试。
断裂强力 参照GB/T3923.1-1997, 采用H10K-S型双臂万能材料试验机(美国TiniiusOlsen公司)测试。
K/S值 在电脑测色配色仪Datacolor 650CIELab 测色系统下,采用D65光源,测定织物的K/S值,测量4个点,取平均值。
2 结果与讨论
2.1 固定化蛋白酶的最佳制备条件
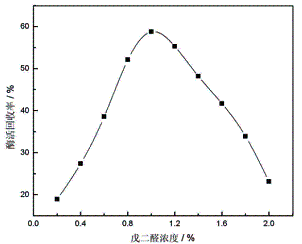
2.1.1 戊二醛浓度对酶活回收率的影响
其他固定化条件不变, 分别加入浓度为0.4%、0.6%、0.8%、1.0%、1.2%、1.4%、1.6%、1.8%、2.0%的戊二醛溶液与载体进行交联反应。
戊二醛浓度对酶活回收率的影响如图1所示:
|
|
|
图1 戊二醛浓度对酶活回收率的影响 |
由图1可知,随着戊二醛浓度的增加,固定化蛋白酶的酶活回收率逐渐增大,当戊二醛的浓度达到1.0%时,其酶活回收率达到最高值;再增加戊二醛的浓度,其酶活呈现逐渐降低的趋势。究其原因,戊二醛的浓度增加,提供的固定化结合位点增多,与游离酶结合的机率增加,有利于酶的固定;但当戊二醛的浓度增加到一定程度,过多的活性位点使酶分子产生过度交联,空间位阻增大、酶活性位点受到限制,使得固定酶的酶活回收率下降。
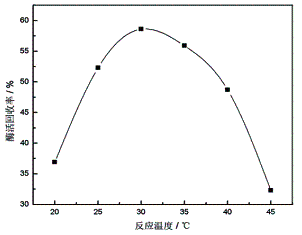
2.1.2 固定化反应温度对酶活回收率的影响
其他固定化条件不变,活化后的载体与蛋白酶分别在20℃、25℃、30℃、35℃、40℃和45℃下反应30min。反应温度对酶活回收率的影响如图2所示:
|
|
|
图2 反应温度对酶活回收率的影响 |
由图2可知,30℃时制备的固定化酶活力回收率最高。这可能是由于温度过低时,体系中醛基与氨基之间相对作用较弱;温度升高,蛋白酶在载体表面运动加剧,促进了载体对酶的吸附;温度过高,酶未与载体完全交联便已失活。
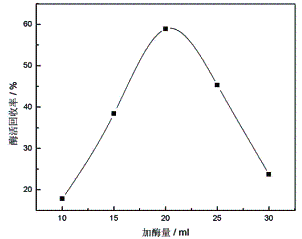
2.1.3 加入蛋白酶的量对酶活回收率的影响
用适宜的缓冲溶液将原蛋白酶稀释成2mg/ml。其他固定化条件不变,活化后的载体加入到10ml、15ml、20ml、25ml、30ml稀释后的酶液
中。加酶量与酶活回收率的关系如图3所示:
|
|
|
图3 加酶量对固定化酶活力的影响 |
由图3可知,当加酶量过低时,载体上所交联的蛋白酶量少,固定化酶活力较低;当加酶量超过20ml时,壳聚糖载体表面交联蛋白酶已趋于饱和,然而残留在溶液中未固定的酶浓度增大,根据公式2可知,酶活回收率降低。因此,本实验确定最佳加酶量为20ml,即蛋白酶与载体的质量比为40mg/g时为最佳。
通过上述实验可得,固定化蛋白酶的最佳制备条件为:戊二醛浓度为1.0%,交联时间为5h,固定化温度为30℃,酶与载体质量比为40mg/g。在此条件下制备的固定化酶固载率为84.4%,酶活回收率可达57.2%。
2.2 固定化蛋白酶和游离蛋白酶性质比较
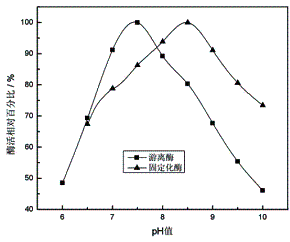
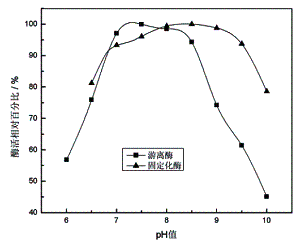
2.2.1 pH值对蛋白酶活力的影响
取一定量的游离蛋白酶或固定化蛋白酶,分别置于pH值为6.0-10.0的缓冲溶液中,测其活
力,找出酶的最适pH值。结果如图4所示:
|
|
|
图4 蛋白酶的最适pH值 |
由图4可知,与游离酶相比,固定化酶的最适pH值向碱性方向移动了1个单位。这可能是由于在碱性溶液中壳聚糖载体带负电,溶液中氢离子和氢氧根离子在固定化酶表面和整体相溶液中不均匀的分布所致。
取一定量的游离蛋白酶或固定化蛋白酶置于pH值为6.0-10.0的缓冲溶液中2h,调回各自最适pH值后再测其活力,并计算酶活相对百分比。游离酶与固定化酶的pH值稳定性如图5所示:
|
|
|
图5 蛋白酶的pH稳定性 |
由图5可知,游离蛋白酶在pH=7-8.5范围内保持较高活力,而固定化蛋白酶可在pH=6.5-9.5的较宽范围内保持较高的活力。由此可推断,酶经固定化后耐酸碱稳定性有所提高。这可能是由于酶经固定化后,空间构型受载体的影响而发生变化,使其对pH值的敏感程度降低所致。
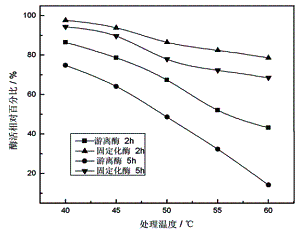
2.2.2 温度对蛋白酶活力的影响
取一定量的游离蛋白酶与固定化蛋白酶,分别在40℃、45℃、50℃、55℃和60℃水浴中振荡2h和5h后,测定酶活并计算酶活相对百分比。结果如图6所示:
|
|
|
图6 温度对酶活力的影响 |
由图6可知,随着处理温度的升高和处理时间的延长,游离蛋白酶和固定化蛋白酶酶活相对百分比都呈降低趋势;然而,在相同处理温度和时间下,固定化蛋白酶的酶活相对百分比均高于游离蛋白酶,显示了比游离酶更佳的耐热稳定性。这可能是由于固定化后酶所处的微环境发生了变化,其活性中心受到载体的影响,活性基因的解离性发生变化所致。
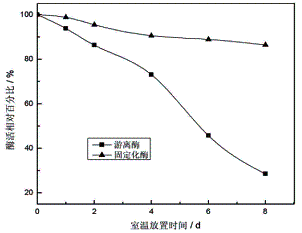
2.2.3 蛋白酶的储存稳定性
将游离蛋白酶与固定化蛋白酶于室温下放置1d、2d、4d、6d和8d。测定酶活并计算酶活相对百分比。结果如图7所示:
|
|
|
图7 酶的储存稳定性 |
由图7可知,在室温时,固定化蛋白酶的储存稳定性比游离蛋白酶更佳。另外,将固定化蛋白酶保存在4℃冰箱中15d后,其活力未见明显损失。
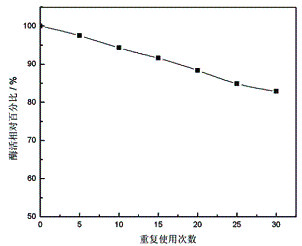
2.2.4 固定化蛋白酶的重复使用性
以质量浓度为2.0%的酪蛋白溶液(pH=7.5)为底物,使定量固定化蛋白酶与之连续进行5、10、15、20、25和30次反应。重复使用次数与酶活相对百分比的关系如图8所示:
|
|
|
图8 固定化酶的重复使用性 |
由图8可知,随着固定化蛋白酶使用次数的增多,酶活力有略微降低的趋势;经使用30次后,固定化蛋白酶活力仍剩余83.8%左右。固定化酶的重复使用性能,提高了酶的利用率,有利于降低生产成本。
3 固定化蛋白酶对羊毛织物抗起毛起球整理效果的影响
按照方法1.2.4,分别采用游离蛋白酶和固定化蛋白酶对羊毛织物进行抗起毛起球整理;按照方法1.2.5,对整理后的羊毛织物进行整理效果的评定。实验结果如表1所示:
表1 游离酶与固定化酶对羊毛整理效果
|
指标试样 |
抗起毛起球等级 |
失重率(%) |
强力保留率(%) |
ΔK/S值 |
|
原布 |
2.5 |
- |
- |
- |
|
游离酶处理 |
4 |
5.7 |
83.6 |
0.08 |
|
固定化酶处理 |
4 |
3.6 |
89.3 |
0.06 |
由表1可知,经游离蛋白酶和固定化蛋白酶整理后,羊毛织物的抗起毛起球等级均提高了1.5级;游离酶处理比固定化酶处理织物的失重率大,分别为5.7%和3.6%;固定化酶处理对织物比游离酶处理的强力保留率高,这可能是由于酶与载体相连后,增大了酶活性中心的空间位阻,使得固定化酶更多的作用在纤维表面;由织物ΔK/S值可知处理前后织物颜色未发生明显变化。
4 结论
(1)固定化蛋白酶最佳制备条件:戊二醛浓度为1.0%,载体活化时间为5h,反应温度为30℃,酶与载体质量比为40mg/g。在此条件下制备的固定化酶固载率为84.4%,酶活回收率可达57.2%。
(2)与游离酶相比,本实验制备的固定化酶显示了更佳的耐酸碱、耐热、储存稳定性和重复使用性。
(3)固定化酶可提高羊毛织物的抗起毛起球1.5个等级,对织物强力保留较好,色光未见变化。这种固定化酶制备方法简便,原料易得,载体与酶均可回收利用,处理效果理想,清洁环保。
参考文献:
[1] 周文龙. 酶在纺织中的应用[M]. 中国纺织出版社,2002年,1;17-21
[2] 张瑞萍,蔡再生. 生物酶在染整加工中的研究与应用综述[J]. 纺织导报,2006年,6;74-78
[3] 李晔. 酶的固定化及其应用[J]. 分子催化,2008年2月,22(1);86-95
[4] Riccardo A, Muzzarelli A, Marco Tomasetti,et al. Depolymerization of
chitosan with the aid of papain[J]. Enzyme Microbial Technology,
1994,16;110-113
[5] Bir E. Preparation of chitosan
particles suitable for enzyme immobilization[J]. Journal of Biochemical and
Biophysical Methods, 2008, 70(6);1240-1246
[6] Krajewska, Barbara. Application of chitin-and chitosan-based materials
for enzyme immobilizations: a review[J]. Enzyme and Microbial Technology, 2004,
35(2-3);126-139
[7] 江龙法,范莽,桑占池. As1.398中性蛋白酶在球形壳聚糖上的固定化研究[J]. 淮海工学院学报,2000年6月,9(2);47-49
[8] Xiao Y. Synthesis and properties of a novel crosslinked chitosan resin
modified by l-lysine[J]. Reactive and Functional Polymers.2008, 68(8);
1281-1289
[9] Chang, Min-Yun. Thermal inactivation and reactivity of
[beta]-glucosidase immobilized on chitosan-clay composite[J]. International
Journal of Biological Macromolecules, 2008, 43(1); 48-53
[10] 王海英,孙谧,王颖. 壳聚糖固定化海洋低温碱性蛋白酶YS-80-122的研究[J]. 海洋水产研究,2008年4月,29(2);41-47
[11] 武军,陶红,梁歧.脱乙酰壳聚糖固定碱性蛋白酶的研究[J]. 食品科学,2005年,26(9);184-186
[12] Kumar, V. S. Conservation of cellulase enzyme in biopolishing
application of cotton fabrics[J]. Journal of the Textile Institute, 2008,99(4);
339-346
[13] 郭秀梅,孙雪桂,刘哲懿. 毛纺产品抗起毛起球整理及测试标准[J]. 毛纺科技,2007年,1;28-30