磁性固定化纤维素酶的制备及其在棉织物抗起毛起球整理中的应用初探
葛凤燕1,2* 胡欣童1,2 蔡再生2 钟业桂1,2 1.纺织面料技术教育部重点实验室,2.东华大学化学化工与生物工程学院
原载: 上海印染新技术交流研讨会论文集(2009年度);367-371
稿件来源:sh9-367
【摘要】以磁性壳聚糖微球为载体,与戊二醛进行共价交联反应制备磁性固定化纤维素酶。分别考察了固定化条件对固定化纤维素酶活力的影响、固定化纤维素酶的稳定性和重复利用性,并将其应用于全棉针织物的抗起毛起球整理中。结果表明,
pH 值为7.0,温度为50℃,EDC和戊二醛的浓度分别为0.25%(W/V)和2.5%(W/V),酶与载体质量比为80mg/g,纤维素酶的固定化效果最好,其固载率为91%,酶活回收率达到65%。与游离酶相比,固定化纤维素酶的pH值稳定性、储存稳定性均有显著提高,且固定化纤维素酶具有较好的循环利用性,连续使用12次后,酶的活力仍保持在75%。将该磁性固定化纤维素酶用于全棉针织物的抗起毛起球整理,其抗起毛起球等级提高1.5级。
生物酶方法应用于棉织物的抗起毛起球整理,生产能耗低,废液易生物降解,符合生态要求。由于纺织加工所用游离酶反应都是在生物体外进行,周围环境因素极易影响到酶的活力,从而对加工过程工艺条件要求非常严格[1,2]。固定化酶则能克服游离酶的不足,并呈现出贮存稳定性高、分离回收容易、可多次重复使用[3-5],操作连续可控,工艺简便等一系列优点。但目前酶的固定化技术[3-5]在印染行业中的应用主要集中于固定化漆酶对染料废水的处理[6-11]的研究,在其他印染整理中的应用却鲜为报道,由此可见,研究固定化酶剂在印染处理中的应用具有重要的理论和实际意义。
本论文以磁性壳聚糖为载体,制备纺织用固定化纤维素酶,探讨了纤维素酶的最佳固定化条件及其酸碱稳定性、热稳定性和储存稳定性,将其应用于全棉针织物抗起毛起球整理,评定其效果。
1 实验材料与方法
1.1 材料与仪器
全面白色针织物 171g/m2 (广州溢达集团)。
药品 纤维素酶(诺维信(中国)投资有限公司);EDC(乙基[3-(二甲胺基)丙基]碳二亚胺盐酸盐,国药集团化学试剂有限公司);壳聚糖(生化试剂,脱乙酰度>90%,国药集团化学试剂有限公司);戊二醛(25%,分析纯,国药集团化学试剂有限公司);四氧化三铁(分析纯,国药集团化学试剂有限公司);其他试剂均为分析纯。
仪器 紫外可见分光光度计(UNICO UV-2000型);高分辨率显微镜(Nikon ECLIPSE E400POL);真空干燥箱(DZG-6021型,上海森信实验仪器有限公司)。
1.2 磁性壳聚糖微球的制备
取0.05g/mL壳聚糖乙酸溶液20mL置于250mL烧杯中,加入0.5g四氧化三铁粉沫,低速搅拌至混合均匀。加入2mL
Span-80、4mL正丁醇、50mL液体石蜡,搅拌混合。60℃滴加2mL甲醛,反应1h,升温至80℃,再滴加1.5mL戊二醛,继续反应1h,冷却,分别用石油醚、丙酮充分冲洗。通过磁场收集磁性壳聚糖微球,于40℃真空干燥。最后将磁性壳聚糖微球进行筛分,备用[12]。
1.3 磁性固定化纤维素酶的制备
取0.5g磁性壳聚糖微球加入到10mL
EDC溶液中,在一定温度和pH值下,置于摇床中反应30min后取出,除去上清液加入定量的纤维素酶缓冲液和10mL一定浓度的戊二醛溶液,继续在上述条件下,进行振荡反应120min,取出,除去上清液,用蒸馏水洗涤至无紫外吸收,于4℃冰箱中保存,备用。
1.4 纤维素酶活力的测定
游离纤维素酶活力检测采用紫外分光光度法[13];固定化蛋白酶活力测定方法同游离酶,将1ml游离酶换成1g固定化酶即可。
纤维素酶活力单位的定义:50℃,最适pH值条件下,单位纤维素酶每分钟水解CMC-Na生成1μg葡萄糖定义为1个纤维素酶活(CMC酶活)单位。相关的酶活计算公式如下:
|
固载率= |
加入酶的总活力 - 未固定酶的活力 |
×100% (公式1) |
|
加入酶的总活力 |
|
酶活回收率= |
固定酶的活力 |
×100% (公式2) |
|
加入酶的总活力 - 未固定酶的活力 |
|
酶活桎百分比= |
某一条件下测定的酶活力 |
×100% (公式3) |
|
该系列条件下最高的酶活力 |
1.5 棉织物的抗起毛起球整理
取2块预处理过的织物,投入含有一定浓度的游离及磁性固定化纤维素酶处理液中(使酶含量达到织物重的2%),在酶最适的温度及pH值条件下,水浴振荡反应30min。反应结束后将织物洗净、烘干。
1.6 整理性能测试
起毛起球性能 参照GB/T 4802.2-1997,采用Nu-Martindale 864型耐磨及起毛起球试验仪(英国JAMES H. HEAL公司)测试。
织物顶破强力 参照GB 3923-97在HD026N电子织物强力仪上测试,测试前于恒温恒湿室平衡24h。
2 结果与讨论
2.1 固定化纤维素酶制备条件的优化
2.1.1 反应温度的影响
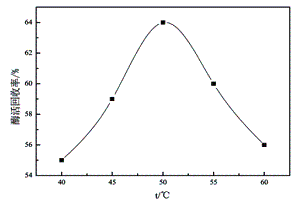
按照方法1.3,在不同温度下进行酶的固定化反应,测试其酶活并计算酶活回收率,得到反应温度与酶活回收率之间的关系曲线如图1所示。
|
|
|
图1 温度对酶活回收率的影响 |
在50℃时固定化纤维素酶的酶活回收率最高,温度过高或过低,酶活回收率均呈现减小趋势。这是因为纤维素酶在固定化过程中,如果温度太低,纤维素酶与载体的交联反应不充分;温度过高则会导致纤维素酶的热失活。综合比较,确定纤维素酶的最佳固定化温度为50℃。
2.1.2 介质pH值的影响
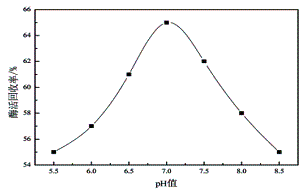
按照方法1.3,分别研究pH值在5.5-8.5的范围内,纤维素酶的固定化反应,图2表明了pH值对固定化纤维素酶的相对活力的影响。当pH值为7.0时,制备的固定化纤维素酶的酶活回收率最高,pH值过高或过低,酶活回收率均有所降低。这是因为在固定化过程中反应介质的pH值直接影响到载体和酶的游离状态,从而影响酶的结合量,造成酶活回收率的差异。因此,确定纤维素酶的固定化pH值为7.0。
|
|
|
图2 pH值对酶活回收率的影响 |
2.1.3 EDC浓度的影响
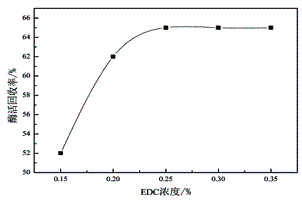
按照方法1.3分别取5份0.5g载体,在不同浓度EDC的条件下,进行固定化反应制备固定化纤维素酶,测定酶活力,结果如图3所示。由图可知,固定化纤维素酶活力随着EDC浓度增加而增加,当EDC浓度达到0.25%后,酶活回收率趋于平衡。EDC是一种羟基活化剂,能够对壳聚糖微球表面的大量羟基进行活化,提高磁性壳聚糖微球表面对纤维素酶的固载量。由于壳聚糖微球表面的羟基数目有限,当EDC浓度达到0.25%时,壳聚糖表面羟基已被完全活化,再增大EDC浓度,酶活回收率不再增加,酶活回收率趋于平衡。
|
|
|
图3 EDC浓度对酶活回收率的影响 |
2.1.4 戊二醛浓度的影响
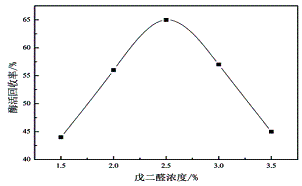
按照方法1.3,分别研究戊二醛浓度对固定化纤维素酶活力的影响,结果如图4所示。随着戊二醛浓度的增加,固定化纤维素酶的酶活回收率逐渐增大,当戊二醛的浓度达到2.5%时,固定化纤维素酶的酶活回收率达到最高值为65%,再增加戊二醛的浓度,其酶活呈现逐渐降低的趋势。究其原因,戊二醛的浓度增加,提供的固定化结合位点增多,与游离纤维素酶结合的机率增加,有利于纤维素酶的固定;但当戊二醛的浓度增加到一定程度,过多的活性位点使酶分子产生过度交联,空间位阻增大、酶活性位点受到限制,使得固定化纤维素酶的酶活回收率下降。因此,确定加入戊二醛的浓度为2.5%。
|
|
|
图4 戊二醛浓度对酶活回收率的影响 |
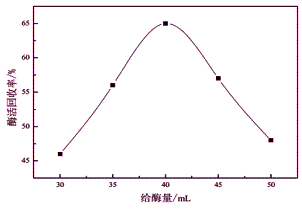
2.1.5 给酶量的影响
按照方法1.3,其他条件固定,分别加入体积为30mL、35mL、40mL、45mL、50mL的游离酶缓冲液进行固化反应。制备的固定化纤维素酶酶活回收率与给酶量之间的关系曲线如图5所示。当给酶量低于40mL时,固定化纤维素酶的酶活回收率随着给酶量的增加而增大。但当给酶量超过40mL时,固定化纤维素酶的酶活回收率却呈现下降趋势。这一方面是因为磁性微球上氨基数目有限,另一方面,随着给酶量增加引起了载体上酶分子密度增大,位阻效应加剧,导致部分酶分子失活,从而造成固定化纤维素酶的酶活回收率下降。因此,确定最佳加酶量为40
mL,即纤维素酶与载体的质量比为80mg/g时为最佳。
|
|
|
图5 给酶量对酶活回收率的影响 |
通过上述实验,确定最佳磁性固定化纤维素酶的制备条件:pH值为7.0,反应温度为50℃,EDC浓度为0.25%,戊二醛浓度为2.5%,酶与载体质量比为80mg/g。在此条件下制备的固定化酶的固载率为91%,酶活回收率可达65%。
2.2 固定化纤维素酶的稳定性能
2.2.1 pH值稳定性
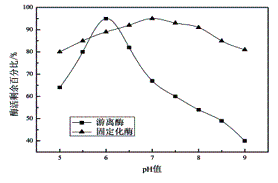
分别取适量游离纤维素酶和固定化纤维素酶于不同pH值缓冲溶液中保温2h后调pH值至7.0,测其活力并计算酶活剩余百分比,结果如图6所示。固定化纤维素酶活力曲线变化比较平缓,酶活受pH值影响较小,相比较而言,游离纤维素酶活力在不同pH值缓冲溶液中变化显著,这表明固定化纤维素酶具有较好的酸碱稳定性。此外,固定化纤维素酶最佳pH值为7.0,游离纤维素酶最佳pH值为6.0,固定化纤维素酶较游离酶的最佳pH值向碱性范围移动了1个单位。
|
|
|
图6 纤维素酶的pH值稳定性 |
2.2.2 储存稳定性
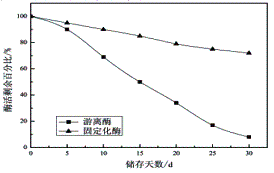
分别取适量磁性固定化纤维素酶和游离纤维素酶于常温放置5d、10d、15d、20d、25d、30d测其酶活,结果如图7所示。在室温下,随着储存时间的增加,固定化纤维素酶和游离的纤维素酶的活力均有一定程度的降低,储存30d后,游离纤维素酶活力仅为原来的8%,而固定化纤维素酶在同等条件下,活力可保持在72%,表明纤维素酶固定化后,储存稳定性大为改善。
|
|
|
图7 纤维素酶的储存稳定性 |
2.3 固定化纤维素酶的重复使用性
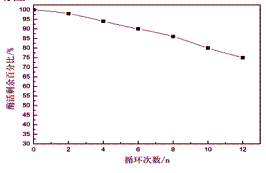
取0.5g磁性固定化纤维素酶,与底物重复反应12次,重复使用次数与酶活剩余百分比的关系如图8所示。固定化纤维素酶的活力随着循环次数的增加而逐渐下降,在循环12次后仍保留原酶活力的75%,这表明固定化纤维素酶具有良好的重复使用性。
|
|
|
图8 固定化纤维素酶的重复使用性 |
2.4 固定化纤维素酶对棉织物抗起毛起球整理效果的影响
将预处理的全棉针织物平衡水分后进行称重,记下初始质量。按照方法1.5,分别采用游离纤维素酶和固定化纤维素酶酶对其进行抗起毛起球整理,按照方法1.6对整理后的织物进行整理效果的评定,结果如表1所示。
表1 全棉针织物整理后性能的测定
|
样品 |
减量率% |
抗起毛起球评级 |
顶破强力保留率% |
|
原布 |
- |
1.5 |
100.00 |
|
游离纤维素酶整理样品 |
3.84 |
3.5 |
83.78 |
|
磁性固定化纤维素酶整理样品 |
3.94 |
3.0 |
88.86 |
由表1可知,在相同用酶量的情况下,固定化酶和游离酶处理的织物与原布相比,抗起毛起球等级分别提高1.5级和2级,游离酶处理后的织物抗起毛起球效果略优于固定化酶处理的织物。这是因为一方面酶在固定化过程中,酶的活性会有所损失,另一方面,载体、酶之间的传质阻力也将影响到固定化酶对纤维的作用效果。图9织物抗毛起球整理效果照片可验证该结论。但由织物处理前后减量率和顶破强力保留率两项指标可知,固定化酶对织物纤维产生的损伤较游离酶处理小,而且固定化酶具有可重复使用性,这些正是游离酶处理所无法比拟的。
(a)原布;(b)游离酶处理的织物起毛起球效果;(c)固定化酶处理的织物起毛起球效果
|
|
|
|
|
(a)原布 |
(b)游离酶处理 |
(c)固定化酶处理 |
|
图9 织物起毛起球照片 |
||
3 结论
(1)磁性固定化纤维素酶的最佳制备条件:pH值为7.0,温度为50℃,EDC浓度为0.25%,戊二醛浓度为2.5%,酶与载体质量比为80mg/g。在此条件下制备的磁性固定化纤维素酶固载率为91%,酶活回收率可达65%。
(2)与游离纤维素酶相比,磁性固定化纤维素酶可在较宽的pH值范围内保持较高的活力,呈现出更好的pH值稳定性和储存稳定性。磁性固定化纤维素酶具有优良的重复使用性能,循环使用12次,其活力仍保留原酶活力的75%。
(3)与原布相比,全棉织物经游离纤维素酶和磁性固定化纤维素酶整理后其抗起毛起球等级分别提高2级和1.5级;与游离酶相比,磁性固定化纤维素酶处理的棉织物强力损伤较小,布面整洁。
参考文献:
[1] Kumar, V. S. Conservation of cellulase enzyme in biopolishing
application of cotton fabrics. Journal of the Textile Institute, 2008,99(4):
339-346.
[2] 周文龙.酶在纺织中的应用.北京:中国纺织出版社,2002.
[3] 禹邦超,文德立.应用酶学导论.武汉:华中师范大学出版社,1994.
[4] Scaramozzino F,Estruch I,Rossolillo P,et al.Improvement of catalytic
properties of Escherichia coli penicillin G acylase immobilized on glyoxyl
agarose by addition of a six-amino-acid tag.Applied and Environmental
Microbiology, 2005, 71(12): 8937-8940.
[5] Cardoso CL,Lima VV,Zottis A,et al.Development and characterization of
an immobilized enzyme reactor(IMER) based on human glyceraldehyde-3-phosphate
dehydrogenase for on-line enzymatic studies.Journal of Chromatography A,2005,
11(5):1-6.
[6] Zaborsky OR.Immobilized enzymes.USA: CRC Press,1974.
[7] Woodward J.Immobilized Cells and Enzymes:A Practical Approach. IRL
Press,1985.
[8] Bir,Emese.Preparation of chitosan particles suitable for enzyme
immobilization[J].Journal of Biochemical and Biophysical
Methods.2008,70(6):1240-1246.
[9] Krajewska B.Application of chitin- and chitosanbased materials for
enzyme immobilizations: a review.Enzyme and Microbial Technology, 2004,
35(2-3):126-139.
[10] Chang MY.Thermal inactivation and reactivity of [beta]-glucosidase
immobilized on chitosanclay composite. International Journal of Biological
Macromolecules. 2008, 43(1): 48-53.
[11] Jiang DS.Immobilization of Pycnoporus sanguineus laccase on magnetic
chitosan microspheres.Biochemical Engineering Journal,2005,25(1): 15-23.
[12] 李冰,邵海员,黎锡流,李琳,刘国琴,浦帅骅.磁性固定化纤维素酶的交联法制备及其磁致酶学性质。河南工业大学学报(自然科学版),2006,27(6):10-14.
[13] 张惟杰.糖复合物生化研究技术[M].第2版.杭州:浙江大学出版社.2003: 10-11.