针对糖尿病创口的抑菌敷料制备及促愈合性能评价yd20524
高层层, 王富平, 梁敏, 孟鑫, 陈忠敏 重庆理工大学 药学与生物工程学院,重庆 400054
收稿日期:2016-09-06;
修回日期:2016-12-28
基金项目:重庆市社会民生科技创新项目(cstc2016shmszx 0635)
作者简介:高层层(1991-),女,硕士研究生,研究方向为生物医用材料。通信作者:王富平,讲师,wangfp2013@cqut.edu.cn
原载:丝绸2017
【摘要】针对糖尿病伤口难愈合的问题,以丝素蛋白、壳聚糖、生物活性玻璃及聚乙烯醇为原料,采用反复冻结-解冻法制备了抑菌促愈合伤口凝胶敷料,通过测定其吸水率、保水率、透水汽性能及抑菌性能,对其进行性能表征。并构建了SD大鼠糖尿病皮肤创面模型,通过对创面愈合时间、创面愈合率进行研究,探讨了该敷料对促进糖尿病皮肤创面愈合的效果。实验结果表明,与市售的海藻酸钠敷料、生物活性玻璃粉末和医用纱布的促愈合性能相比,该敷料能加速创面的愈合,促进肉芽组织的生长。
【关键词】糖尿病;创口;抑菌敷料;丝素蛋白;创面愈合;性能评价
【中图分类号】TQ314.1 文献标志码:A 文章编号:1001-7003(2017)03-0013-07 引用页码: 031103 DOI:10.3969/j.issn.1001-7003.2017.03.003
目前,糖尿病(diabete mellitus,DM)的发病率呈逐年上升趋势,糖尿病病人伤口不易愈合,患者血液中高浓度的葡萄糖渗透到组织间,损伤机体组织和细胞的损伤修复系统[1],并易引发伤口感染,包括革兰氏阳性球菌、格兰氏阴性杆菌在内的多种需厌氧菌和真菌的混合感染[2],使得糖尿病人伤口难以愈合。目前,临床上使用的敷料主要有传统敷料和新型湿性敷料。传统敷料即纱布、碘仿纱条等,以传统的保持创面干燥为指导原则进行换药治疗[3],几乎无促愈合功效。新型湿性敷料包括以透明薄膜式敷料为代表的覆盖型外层敷料;以藻酸盐敷料、伤口胶为代表的内层填塞型敷料;以银离子敷料为代表的抗菌性敷料等,以湿性愈合为原理,能创造利于细胞生长适宜的湿润环境,敷料密闭或半密闭伤口能保持伤口恒温,防止细菌及外界颗粒性异物侵入,减少伤口感染机会,促伤口愈合[4]。但其在湿润环境下吸收渗液的特性及通透性差,最终出现感染情况多,成为医学上难题。
丝素蛋白(silk fibroin, SF)是一种天然高分子蛋白质,含有18种氨基酸,具有良好的生物相容性和可生物降解性[5],对表皮细胞的生长有促进作用[6-7],并有助于创面愈合[8]。壳聚糖(chitosan, CS)是一种天然多糖,广泛存在于自然界,具有止痛、止血、促进伤口愈合,良好的生物相容性和抑菌性等优异的性能,非常适于作为伤口敷料的原料[9]。生物活性玻璃(bioactive glass, BG)的主要成分为SiO2、CaO、P2O5,具有独特的表面活性,钙、磷等离子沉积生成支架状羟基磷灰石层,使其具有巨大的比表面积,有利于细胞的黏附生长及血管和神经长入[10-11]。另外,生物活性玻璃在被创面组织渗液溶解后,能在局部形成碱性环境,可发挥一定的抑菌作用,利于创面愈合[12]。聚乙烯醇(polyvinyl alcohol, PVA)水凝胶具有亲水性、柔软性和良好的生物相容性,被广泛应用于生物医药领域[13]。PVA水凝胶含有大量的水分,能够使伤口处保持湿润,同时可以吸收伤口渗液,保持伤口清洁。因此,天然高分子材料及生物活性玻璃的联合使用,将会为难愈合伤口的治疗带来希望。
本研究以丝素蛋白、壳聚糖、生物活性玻璃、聚乙烯醇为原料,采用冻结-解冻法制备出水凝胶抑菌敷料,并利用链脲佐菌素(streptozotocin, STZ)通过葡萄糖转运蛋白进入细胞后,对胰腺胰岛素诱发的抑制作用,构建糖尿病大鼠皮肤创面模型,并研究敷料的相关性能及应用于糖尿病大鼠皮肤创面的愈合效果。
1 实 验
1.1 原料与试剂
家蚕茧壳(重庆市纤检所);透析袋(Solarbio,进口分装,标定截留相对分子质量8 000~140 000);无水乙醇、异丙醚、无水碳酸钠、盐酸、磷酸三乙酯、正硅酸乙酯、四水硝酸钙、聚乙烯醇1799、柠檬酸、柠檬酸三钠均为市售分析纯;壳聚糖(<200 mPa·s,西亚试剂);链脲佐菌素购于sigma;陆眠宁(吉林省华牧动物保健品有限公司)。
1.2 丝素蛋白的制备
将去除灰分和蜡质物的茧壳放0.5% Na2CO3溶液中煮沸约3 h,去除丝胶。将除去丝胶的茧壳用去离子水洗净后晾干,置于m(CaCl2)︰m(C2H5OH)︰m(H2O)=1︰2︰8的有机无机溶液中,水浴80 ℃下使丝素完全溶解,得到透明的丝素溶液,经透析、抽滤、浓缩、冷冻干燥,得到纯净的丝素蛋白粉末。
1.3 生物活性玻璃粉末的制备
将各原料按照一定比例混合均匀,室温下密闭搅拌1 h,在室温下陈化3 d,得到均匀溶胶。将均匀溶胶放入75 ℃鼓风干燥箱中1 d,得到均匀湿凝胶。将湿凝胶放150 ℃鼓风干燥箱中,得到干凝胶粉末。再将干凝胶放入马弗炉中,700 ℃维持2 h,待冷却后取出,即得到生物活性玻璃粉末。将生物活性玻璃研磨后过筛,得到粒径为75~100 μm的生物活性玻璃粉末。
1.4 抑菌促愈合敷料的制备
在室温下,将丝素蛋白溶液和生物活性玻璃混合均匀后,再加入壳聚糖溶液和聚乙烯醇溶液搅拌成混合溶液,搅拌约30 min;将混合溶液倒入模具中,于-20 ℃冷冻8~10 h,再于室温下解冻,如此反复3次,即可得到能够促进难愈合伤口愈合的敷料材料(本文称为抑菌促愈合敷料)。
1.5 动物模型构建及分组
实验选择由重庆市大坪医院动物中心提供的体重为200 g左右的雄性SD大鼠[14],适应环境3 d,实验组喂食高糖高脂饲料,对照组喂食普通饲料,4周后腹腔注射STZ。实验前禁食不禁水12 h[15-16],按30 mg/kg腹腔注射STZ,隔日注射,注射在腹腔同侧[17],注射后单笼饲养。对照组按30 mg/kg腹腔注射柠檬酸-柠檬酸钠缓冲液。注射后3 d的空腹血糖≥11.1 mmol/l[18]即为成模标准。连续3周监测大鼠血糖值,实验组继续喂食高糖高脂饲料以维持高血糖。3周后,以0.6 mL/kg肌肉注射陆眠宁麻醉大鼠,将大鼠背部除毛,生理盐水擦洗干净,碘伏擦拭消毒。剪刀、镊子等浸入医用酒精中消毒。以大鼠脊柱为中线,制作三个边长约为1 cm的背部全层皮肤切除创面。按照双盲随机法,使用抑菌促愈合敷料、市售海藻酸钠敷料、生物活性玻璃粉末及医用纱布外敷创面,四者均用纱布固定,隔日换药。
1.6 创面用敷料的性能评价
为使病人在伤口愈合期间能保持伤口舒适,敷料的主要功能体现在以下几方面:①吸收伤口渗液;②提供湿润环境;③抑制细菌滋生;④促进伤口愈合;⑤提供营养物质。从以上要求可得出要测定敷料的吸水率、保水率、透水汽性能及抑菌性能。
1.6.1 吸水率和保水率的测定
室温下,将一定质量的敷料浸入去离子水中24 h,滤纸吸干表面水分称其质量为m1,滤纸包裹敷料放入离心机中离心10 min(10 000 r/min),离心后称重为m2,将敷料放入105 ℃烘箱中3 h,直至称其质量为恒重,记为m0。其吸水率qx、保水率qb按下式计算:
|
|
|
|
1.6.2 透水汽性能的测定
配置A液(8.3 g NaCl+0.277 g CaCl2+1 000 mL去离子水),取20 mL A液于透湿杯中,将敷料切割成杯口大小,放置杯口并用螺栓固定,将透湿杯放于37 ℃烘箱中。在实验开始前及24 h后称取透湿杯质量,减少的质量为液体透过敷料散发到环境中的质量。若透湿杯的内直径为D,24 h内减少的质量为W,敷料的透水汽性R按下式计算:
|
|
式中:R为敷料的透水汽性,g/(m2·d);W为24 h内减少的质量,g;D为透湿杯的内直径,m。
1.6.3 抑菌性能测定
将冻干敷料材料浸入PBS缓冲液中(0.2 g/mL),37 ℃恒温浸提24 h。以此为原液,分别得到0.2、0.1、0.05、0.025 g/mL的浸提液,分别研究对大肠杆菌、金黄色葡萄球菌及绿脓杆菌的抑菌性。
1.7 糖尿病模型评价
每周记录大鼠体重,测量血糖值并计算脏器系数。对比注射STZ前后大鼠体重、血糖值及脏器系数的变化。
1.8 创面愈合评价
观察术后各时间点伤口愈合情况,记录创面愈合时间。用拍照法记录创面面积,计算创面愈合率。创面愈合率/%=(原始创面面积-未愈合创面面积)/原始创面面积×100。
1.9 统计学分析
各组实验数据均用(平均值±标准差)表示,所得数据均用SPSS 19.0统计软件进行统计学处理,实验组间差异的显著性用单因数方差分析进行检验,p<0.05具有统计学意义。
2 结果与分析
2. 1 氨基酸分析结果检测
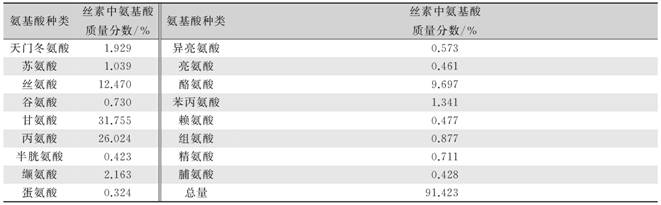
由表1分析结果显示,丝素蛋白中含有18种氨基酸,其中丝氨酸、甘氨酸、丙氨酸、酪氨酸质量分数较高,易被人体吸收利用,可为伤口处组织提供营养物质,促进伤口的愈合。
|
表1 丝素蛋白氨基酸组成分析结果 |
|
|
氨基酸种类丝素中氨基酸质量分数/%氨基酸种类丝素中氨基酸质量分数/%天门冬氨酸1.929异亮氨酸0.573苏氨酸1.039亮氨酸0.461丝氨酸12.470 酪氨酸9.697谷氨酸0.730苯丙氨酸1.341甘氨酸31.755 赖氨酸0.477丙氨酸26.024 组氨酸0.877半胱氨酸0.423精氨酸0.711缬氨酸2.163脯氨酸0.428蛋氨酸0.324总量91.423
2.2 生物活性玻璃的XRD分析
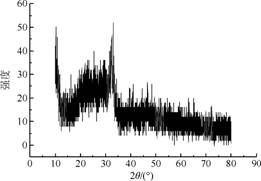
如图1所示,生物活性玻璃呈现出宽阔、弥散、尖锐的衍射峰,说明是非晶态或无定形态无机固体颗粒。其中Si-O-Si、P-O-P、Si-O-P键的键角均在一定范围内变动,不具有固定的键角和晶格间距,使得非晶态物质具有短程有序、长程无序的结构,它们是以非晶态为主要特征。
|
|
|
图1 生物活性玻璃的XRD图谱 |
2.3 敷料的性能
2.3.1 敷料的吸水率和保水率
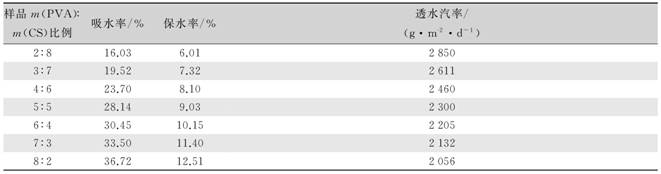
随着敷料中壳聚糖比例的增加,敷料的吸水率和保水率均增加,说明壳聚糖具有较好的吸水性能和保水性能,可有效吸收伤口渗出液,并能维持伤口处湿润,避免伤口干燥,有利于伤口的愈合。
2.3.2 敷料的透水汽性能
理想的敷料应能够将伤口透水汽率控制在一定范围内[19]:正常皮肤为204 g/(m2·d),受伤皮肤为279~5 238 g/(m2·d),推荐的医用敷料的透水汽率为2 500 g/(m2·d)。随着壳聚糖比例的增加,制备的难愈合伤口敷料的透水汽率减少。由表2可知,在m(CS)︰m(PVA)为4︰6时的透水汽率最接近医用敷料推荐值。
|
表2 抑菌促愈合伤口敷料的物理性能 |
|
|
样品m(PVA)︰m(CS)比例吸水率/%保水率/%透水汽率/(g·m-2·d-1)2︰816.036.0128503︰719.527.3226114︰623.708.1024605︰528.149.0323006︰430.4510.1522057︰333.5011.4021328︰236.7212.512056
2.3.3 敷料的抑菌性
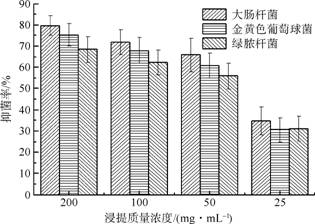
由图2可知,敷料浸提液对大肠杆菌、金黄色葡萄球菌、绿脓杆菌均具有较强的抑菌性,材料浸提液浓度越大,抑菌性越强。一方面可能是因为壳聚糖溶液中的氨基![]() ),能与细菌细胞壁结合形成负电环境,破坏细菌细胞壁的完整性,进而破坏细菌直至死亡;另一方面可能是因为丝素蛋白的某些氨基能够吸附细菌,干扰细菌的正常生命活动,产生相应的抑菌性;还有一方面可能是生物活性玻璃对细菌的抑制作用。有文献显示,生物活性玻璃能够在局部形成碱性环境,能发挥一定的抑菌作用。综上述分析,材料浸提液对大肠杆菌的抑菌性高于金黄色葡萄球菌和绿脓杆菌,这可能与细菌的结构和耐药性有关,大肠杆菌属于革兰氏阴性菌,细胞壁呈二维结构且较薄;金黄色葡萄球菌属于革兰氏阳性菌,细胞壁呈三维结构且较厚;绿脓杆菌属于假单胞菌,是临床上常见的耐药性较强的革兰氏阴性菌。
),能与细菌细胞壁结合形成负电环境,破坏细菌细胞壁的完整性,进而破坏细菌直至死亡;另一方面可能是因为丝素蛋白的某些氨基能够吸附细菌,干扰细菌的正常生命活动,产生相应的抑菌性;还有一方面可能是生物活性玻璃对细菌的抑制作用。有文献显示,生物活性玻璃能够在局部形成碱性环境,能发挥一定的抑菌作用。综上述分析,材料浸提液对大肠杆菌的抑菌性高于金黄色葡萄球菌和绿脓杆菌,这可能与细菌的结构和耐药性有关,大肠杆菌属于革兰氏阴性菌,细胞壁呈二维结构且较薄;金黄色葡萄球菌属于革兰氏阳性菌,细胞壁呈三维结构且较厚;绿脓杆菌属于假单胞菌,是临床上常见的耐药性较强的革兰氏阴性菌。
|
|
|
图2 敷料浸提液的抑菌性 |
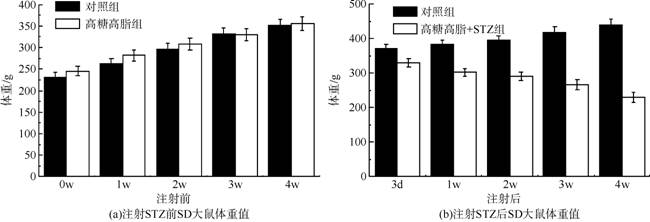
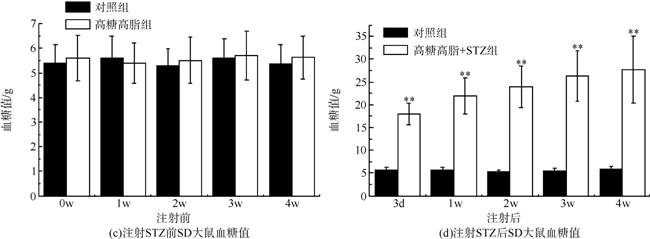
2.4 注射STZ前后大鼠体重、血糖值的变化
图3(a)(b)为注射STZ前后大鼠的体重值变化情况。从图3(a)可以看出,在注射STZ之前,实验组和对照组的大鼠体重均呈现稳步上升趋势。从图3(b)可看出,实验组大鼠体重值呈下降趋势,而对照组大鼠体重持续上升。在注射STZ 2周内体重减少(p<0.05),但在2周后体重明显下降(p<0.01),可能继续喂食高糖高脂饲料使得大鼠糖尿病病情加重。图3(c)(d)为注射STZ前后大鼠的血糖值变化情况。由图3(c)可知,实验组和对照组大鼠的血糖值均维持在正常水平。从图3(d)可以看出,实验组大鼠注射STZ后,血糖值急剧上升(p<0.01),达到了糖尿病血糖水平,继续喂食高糖高脂饲料,大鼠的血糖值亦会继续上升。对照组大鼠血糖值一直稳定在正常水平。
|
|
|
|
|
*表示p<0.05,**表示p<0.01 vs 对照组,w为周(即7 d) |
|
图3 注射STZ前后SD大鼠的体重及血糖值 |
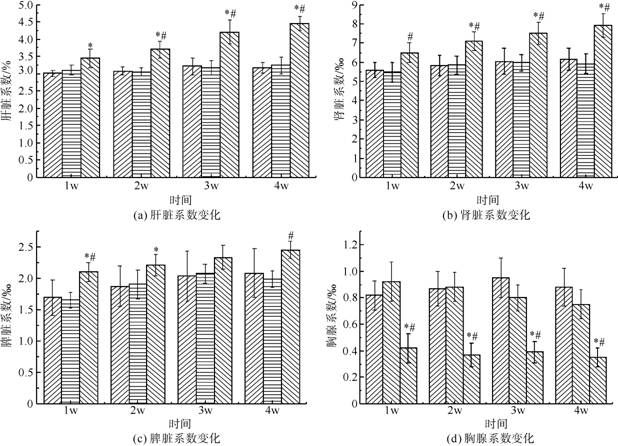
2.5 注射STZ前后大鼠脏器系数的变化
图4为注射STZ前后SD大鼠各脏器系数变化情况。从图4(a)可以看出,高糖高脂组与对照组肝脏系数基本一致,注射STZ会对肝脏产生损伤。从图4(b)可以看出,高糖高脂组与对照组肾脏系数基本一致,注射STZ会对肾脏产生损伤,肾脏系数呈上升趋势(p<0.05)。从图4(c)可以看出对照组大鼠与高糖高脂组大鼠脾脏系数基本一致,STZ对脾脏也有一定的影响(p<0.05)。从图4(d)可以看出,高糖高脂喂食对胸腺损伤不明显,注射STZ会对胸腺造成损伤(p<0.05),大鼠胸腺明显萎缩,体积减小。
|
|
|
*表示p<0.05 vs对照组, #表示p<0.05 vs 高糖高脂组,w为周(即7 d) |
|
图4 注射STZ前后SD大鼠脏器系数的变化 |
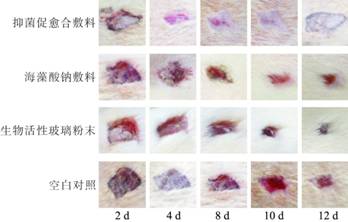
2.6 大鼠创面愈合情况
通过对创面的肉眼观察(图5)可以看出,2 d时,海藻酸钠敷料组伤口处有部分肉芽组织形成,抑菌促愈合敷料组伤口表面有一层白色物质生成,生物活性玻璃粉末组也有部分白色物质生成。4 d时,抑菌促愈合敷料组创面减小,生物活性玻璃粉末组创面也有减小,其他两组均未发生明显变化。8 d时,抑菌促愈合伤口敷料组创面明显减小,肉芽组织充满创面,创面颜色变淡,海藻酸钠组亦形成肉芽组织,创面有所减小,生物活性玻璃粉末组创面也明显减少,并有肉芽组织生成,空白对照组有部分肉芽组织生成。10 d时,抑菌促愈合敷料组新生上皮组织已大部分覆盖创面,海藻酸钠组创面明显减小,生物活性玻璃粉末组创面愈合速度超过海藻酸钠组,空白对照组创面减小不明显。12 d时,抑菌促愈合敷料组新生上皮组织已完全覆盖创面,伤口完全愈合,海藻酸钠组创面减小但未完全愈合,生物活性玻璃粉末组亦未完全愈合,空白对照组有肉芽组织形成,创面有一定减小。
|
|
|
图5 糖尿病大鼠术后各时间点创面愈合情况 |
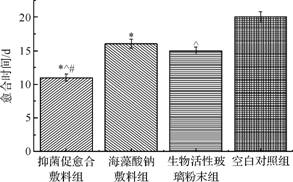
从创面愈合时间(图6)可以看出,抑菌促愈合敷料组平均愈合时间为(11.2±0.5)d,海藻酸钠敷料组为(16.1±0.67)d,生物活性玻璃粉末组为(15±0.5)d,空白对照组为(20.5±1.2)d,且抑菌促愈合敷料组与空白对照组相比有显著性差异(p<0.05),
抑菌促愈合敷料组愈合时间明显短于海藻酸钠敷料组、生物活性玻璃粉末组及空白对照组(p<0.05)。
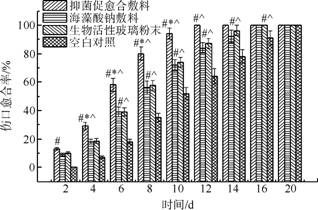
从创面愈合率(图7)来看,同一时相点抑菌促愈合敷料的愈合率明显高于海藻酸钠敷料组、生物活性玻璃粉末组和空白对照组(p<0.05),愈合较快。
|
|
|
*表示p<0.05 vs 空白对照组, #表示p<0.05 vs 海藻酸钠敷料组, ^表示p<0.05 vs 生物活性玻璃粉末组 |
|
图6 各组创面的愈合时间 |
|
|
|
#表示p<0.05 vs 空白对照组, *表示p<0.05 vs 海藻酸钠敷料组, ^表示p<0.05 vs 生物活性玻璃粉末组 |
|
图7 各组创面各时相点的创面愈合率 |
3 结 论
1)壳聚糖具有较强的吸水率和保水率,聚乙烯醇的透水汽性良好,在m(CS)︰m(PVA)为4︰6时透水汽率达到2 460 g/(m2·d),最为接近医用敷料的理想值2 500 g/(m2·d),同时,吸水率和保水率分别达到了23.70%和8.10%,能够吸收伤口渗液并伤口保持湿润。
2)抑菌促愈合敷料具有较好的抑菌性,随浸提液浓度的增加抑菌性增强。其中,抑菌性从大到小的顺序为:大肠杆菌,金黄色葡萄球菌,绿脓杆菌。
3)高糖高脂喂食SD大鼠4周后腹腔注射STZ能够使大鼠血糖急剧升高,体重减少,出现“三多一少”的症状。大鼠的脏器系数也会发生变化,尤以胸腺系数变化最为明显。
4)抑菌促愈合敷料能够促进糖尿病大鼠皮肤创面的愈合,平均愈合时间为(11.2±0.5)d。愈合时间明显少于市售海藻酸钠敷料组、生物活性玻璃粉末组和空白对照组。
参考文献:
[1]徐国恒.糖尿病病人伤口为什么不容易愈合[J].生物学通报,2007,42(9):53.
[2]LIPSKY B A, RENDT A R, HEERY H G, et a1. Diagnosis and treatment of diabetic foot infections[J]. Guidelines for Diabetic Foot Infections,2004,39:885-910.
[3]朱莉.湿性敷料对糖尿病足溃疡渗出液中TGF-β1和IL-1β的动态影响及疗效观察[D].长沙:中南大学,2013:1-5.
[4]宋妮,赵玲玲.康惠尔伤口护理敷料在压疮治疗中的应用[J].基层医学论坛,2010,14(18):525-526. S
[5]黄泉,杨吉成,缪竞诚.丝素蛋白材料生物相容性评价研究进展[J].国际生物医学工程杂志,2007,30(3):163-166.
[6]陆旋,朱正华,周晓红.促细胞生长再生复合丝素蛋白电纺丝非织布的性能[J].蚕业科学,2010,36(1):97-101.
[7]CHIARINI A, PETRINI P, BOZZINI S, et al. Silk fibroin/poly(carbonate)-urethane as a substrate for cell growth: in vitro interactions with human cells[ J]. Biomaterials,2003,24(5):789-799.
[8]顾晋伟,杨新林,朱鹤孙.丝素蛋白作为生物材料的研究进展[J].材料导报,2001,15(11):46-48.
[9]陈煜,窦桂芳,罗运军,等.甲壳素和壳聚糖在伤口敷料中的应用[J].高分子通报,2005(1):94-98.
[10]李娜,王超,朱苏敏,等.聚乙二醇作造孔剂制备大孔溶胶凝胶生物活性玻璃[J].无机化学学报,2005,1(1):95.
[11]JONES J R, LEE P D, HENCH L L. Hierarchical porous materials for tissue engineering[J]. Philos Transact A Math Phys Eng Sci,2006,364:263-281.
[12]王钰,马兵,夏照帆,等.生物活性玻璃对30例烧伤患者的治疗后期创面的疗效观察[J].中华烧伤杂志,2006,22(6):474..
[13]SAILAJA G S, SREENIVASAN K, YOKOGAWA Y, et al. Bioinspired miner-alization and cell adhesion on surface functionalized PVA films[J]. Acta Biomater,2009,5(5):1647.
[14]WILSON R D, ISLAM M S. Fructose-fed streptozotocin-injected rat: an alternative model for type 2 diabetes[J]. Pharmacol Rep,2012,64(1):129-139.
[15]胡玉焕,宁亚功,肖燕.高热量饮食联合链脲佐菌素建立2型糖尿病大鼠模型的影响因素[J].江西中医学院学报,2013,25(1):70-73.
[16]施红,金国琴,余文珍.诱导构建最佳类似人类2型糖尿病大鼠的造模方式[J].中国临床康复,2005,9(39):69-71.
[17]章成昌,谢光荣,姜玉涛,等.链脲佐菌素制备2型糖尿病大鼠模型的研究[J].安徽医药,2012,16(9):1241-1244.
[18]袁鑫,蔡雪洲,谢航,等.改良2型糖尿病大鼠模型的构建[J].湖北科技学院学报(医学版),20l4,28(6):472-474.
[19]PLEPIS A M G, DAS-GUPTA D K, GOISSIS G. Pyroelecties of anionic collagen and anionic collagen: P(VDE/TRFE) composites[J]. International Symposium on Electres,1999,10:233-236.