石墨烯及其复合材料在重金属离子吸附方面的应用yd20024
曹明莉1,张会霞1,张聪2,盛智博1 1. 大连理工大学 土木工程学院,辽宁 大连 116024; 2. 江南大学 环境与土木工程学院,江苏 无锡 214000
*收到初稿日期:2015-07-19
收到修改稿日期:2015-10-10
作者简介:曹明莉 (1971-),女,河南开封人,副教授,主要从事碳酸钙晶须、石墨烯纳米材料研究。
通讯作者:张会霞,E-mail: zhanghuixia199016@163.com
原载:功能材料/2016
【摘要】重金属污染是目前最为严峻的环境污染问题之一,因此,寻找高效的纳米材料去除水中的重金属变的尤为重要。作为碳系家族的新成员,石墨烯已经成为万众瞩目的研究热点。由于具有超大的比表面积、较高的机械强度和稳定的化学性质等突出优势,石墨烯不仅在场效应晶体管、催化、药物输送等领域应用前景广阔,而且作为吸附材料在重金属离子处理方面的潜能也备受关注。综述了近年来有关石墨烯及其复合材料吸附水溶液中重金属离子的研究,系统介绍了石墨烯基材料对重金属离子的吸附效果、吸附机理、影响因素,及该材料的脱附再生性能。最后,对石墨烯及其复合材料研究过程中的挑战进行了评述,同时对它们在水处理过程中的应用前景做了深入探讨和展望。
【关键词】石墨烯;重金属离子;吸附;水处理
【文章编号】 1001-9731(2016)08-08001-07 中图分类号:X703 文献标识码:A DOI:10.3969/j.issn.1001-9731.2016.08.001
0 引言
水资源是人类不可或缺的自然资源,但随着现代工业的日益发展,大量含铅、铜、铬等重金属离子的工业废水直接排入天然水体之中,造成水源中重金属积累加剧[1]。重金属离子毒性大、不易降解,长期在水体中分散存在,最终通过食物链生物富集,对自然环境、生态系统及人体健康产生严重危害[2]。因此,如何有效地去除废水中的重金属离子已成为当前亟待解决的问题之一。目前已开发应用的重金属废水处理方法很多,传统的有沉淀法、过滤法、离子交换法、膜分离法等[3]。然而,这些方法均存在一定的技术或经济方面的局限性,如沉![]() 淀法虽然经济方便,但会产生难以处理的化学制品,带来垃圾填埋问题;膜分离法具有节能、分离效率高等优点,但经济可行性低,维护费用高,不适合大规模应用。在实际应用中,吸附法因其操作简单,成本低廉,选择性好而受到人们的青睐。
淀法虽然经济方便,但会产生难以处理的化学制品,带来垃圾填埋问题;膜分离法具有节能、分离效率高等优点,但经济可行性低,维护费用高,不适合大规模应用。在实际应用中,吸附法因其操作简单,成本低廉,选择性好而受到人们的青睐。![]() 吸附法的关键是找到有效的吸附剂,该吸附剂应具有吸附率高、吸附容量大、吸附速率快及再生能力强等特征。其中,活性炭[4-6]、碳纳米管[7-8]、沸石[9]、壳聚糖[10-11]及树脂[12-13]等均曾被用作废水处理吸附材料,但这些材料存在着再生难、吸附速度慢、选择性差等缺点。
吸附法的关键是找到有效的吸附剂,该吸附剂应具有吸附率高、吸附容量大、吸附速率快及再生能力强等特征。其中,活性炭[4-6]、碳纳米管[7-8]、沸石[9]、壳聚糖[10-11]及树脂[12-13]等均曾被用作废水处理吸附材料,但这些材料存在着再生难、吸附速度慢、选择性差等缺点。
作为碳系家族的一员,石墨烯(graphene,GN)自发现以来,便以其优异的性能引起了物理、化学、材料等各领域科技工作者的广泛关注[14-15]。完美的石墨烯是由单层碳原子经过sp2杂化形成的蜂窝状正六边形晶格的二维碳质新材料,其厚度仅为0.335 nm(图1)[16]。狭义上只有单层石墨才属于石墨烯,而现在所说的石墨烯通常是广义的概念,即10层以下的石墨都可算是二维石墨烯材料,包括单层(Single-layer Graphene,SG)、双层(Bi-layer Graphene,BG)和少层石墨烯(3≤层数≤10,Few-layer Graphene,FG)。影响吸附剂吸附性能的主要因素是其比表面积和结构,而石墨烯具有超大的比表面积(单层比表面积接近2 630 m2/g,多层为270~1 550 m2/g)[17-18]和丰富的孔隙结构,这一点成为其良好吸附性能的基础。因此,我们有理由相信,石墨烯是一种理想的吸附剂或分离材料。
|
|
|
图1 石墨烯结构示意图[19] |
近年来,许多学者开展了对石墨烯及其衍生物在储氢、消除水相污染物等方面的研究,并取得了卓有成效的结果。本文较为系统地阐述了石墨烯及其复合材料对水溶液中重金属离子的吸附效果、吸附机理、影响吸附的相关因素,及该材料的脱附再生性能,并就石墨烯及其复合材料研究的挑战进行了评述。
1 石墨烯及其复合材料的吸附性能
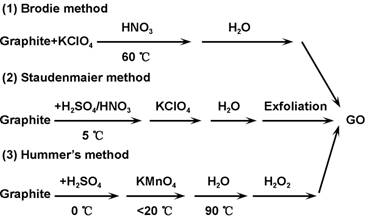
结构完整的二维石墨烯晶体表面光滑且呈惰性,化学稳定性高,与其它介质的相互作用较弱。此外,由于其相邻片层之间的π-π作用,石墨烯极易发生团聚或重新堆积形成石墨,从而阻碍了石墨烯的进一步研究和应用。广大学者通常采用的是氧化石墨烯(Graphene oxide,GO)及以GO为前驱体形成的其它复合材料。GO一般是由石墨经化学氧化、超声制备获得,常用的石墨氧化方法主要有Brodie法[20]、Staudenmaier法[21]以及Hummers法[22],其制备过程如图2所示。作为石墨烯的衍生物,GO结构与石墨烯大体相同,只是在二维基面上连有大量的—COOH、—OH等含氧官能团。这些含氧基团不仅可明显改善其水溶性,还可成为活性吸附位点吸附重金属,进而有效分离废水中的重金属离子。更为重要的是,大量含氧官能团的引入使得GO能够稳定存在于多种常用的有机溶剂中,成为了制备石墨烯基复合材料的前驱体。
|
|
|
图2 GO的制备过程 |
石墨烯基复合材料是以石墨烯与其它成分复合后所制备的材料,这种材料不仅可以同时保持石墨烯和所复合材料的优越性,而且能产生新的协同效应。石墨烯基复合材料的制备大多是先将GO与金属、金属氧化物以及聚合物复合,再将复合后的材料还原得到的。目前,石墨烯基复合材料的研究主要集中于石墨烯/无机纳米复合材料和石墨烯/聚合物复合材料[23-24]。
|
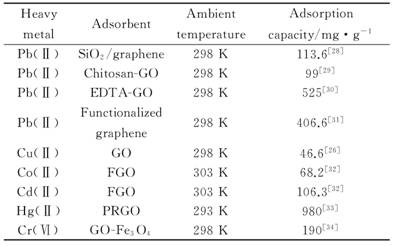
表1 石墨烯及其复合材料对重金属离子吸附量 |
|
|
|
HeavymetalAdsorbentAmbienttemperatureAdsorptioncapacity/ mg·g-1Pb(Ⅱ)SiO2/graphene298K113.6[28]Pb(Ⅱ)Chitosan -GO298K99[29]Pb(Ⅱ)EDTA-GO298K525[30]Pb(Ⅱ) Functionalizedgraphene298K406.6[31]Cu(Ⅱ) GO298K46.6[26]Co(Ⅱ)FGO303K68.2[32]Cd(Ⅱ) FGO303K106.3[32]Hg(Ⅱ)PRGO293K980[33]Cr(Ⅵ)GO-Fe3O4298K190[34] |
关于石墨烯及其复合材料的吸附性能,大部分的研究均是针对无机污染物,表1汇总了石墨烯基材料对重金属离子的吸附量。由此可见,石墨烯及其复合材料能有效吸附水中的Pb(Ⅱ)[25],Cu(Ⅱ)[26],Co(Ⅱ)[27]等多种重金属离子。
2 影响吸附的因素分析
石墨烯材料对无机污染物的去除效果不仅与石墨烯本身层数、缺陷等有关,还会受到吸附条件如重金属离子浓度、吸附剂用量、吸附温度和时间等多种因素的影响,再加上重金属离子各自性质的不同,因此,石墨烯及其复合材料对各种重金属离子的吸附性能往往存在一定的差异。
2.1 吸附剂用量对吸附的影响
吸附剂用量直接关系着对重金属离子的吸附效果和吸附成本,在实际应用中是一个重要的考察指标。Wang等[35]发现Zn2+吸附量随着GO掺量的增多而降低。虽然活性吸附位点随吸附剂量的增加而增多,但是,Zn2+与GO表面官能团羰基(-C=O)之间的相互作用有可能诱导GO团聚/褶皱,降低其有效比表面积,另一方面,吸附剂用量增大时,GO-GO颗粒间的聚合作用对吸附效果也造成了一定的阻碍。
Wu等[36]在研究GO用量对Cu2+吸附效果的影响时,也报道了相似的趋势。该试验结果表明,当吸附剂用量为1 mg/L时,吸附效果达到最佳。
石墨烯基材料与其它吸附剂类似,低掺量下使用对重金属离子吸附量更大,其结合位点和比表面积能够得到有效利用[37-38]。因此,建议在实际应用中,采用适当吸附剂用量,使其达到既有较好的吸附效果,又能降低吸附成本的目的。
2.2 接触时间对吸附的影响
吸附时间是影响吸附剂吸附重金属离子的一个重要因素,随着吸附时间的延长,处理周期延长,经济效益必将受到影响。石墨烯基材料的层状结构和较大的比表面积将有助于其吸附重金属离子速率的提高,大大缩短达到平衡状态所需的时间。Deng等[31]指出,在最初的20 min内,GNSPF6(以KPF6为修饰试剂,制备的功能化石墨烯)对Pb2+、Cd2+的吸附量快速增长,随后增长缓慢并在40 min内达到平衡。Madadrang等[30]也研究了时间对Pb2+去除率的影响,发现EDTA-GO复合材料吸附Pb2+的过程只需20~30 min即可达到动态平衡,远快于其它吸附剂(如活性炭,CNTs)[39-41],表明石墨烯材料有很高的工业应用价值。
石墨烯基宏观体材料是石墨烯片层组装构建而成的宏观形态的新型碳质材料,不仅保持了石墨烯片层良好的物理化学性质,同时具有可调控的微观结构和宏观形态。Li等[42]以NiCl2·6H2O为催化剂前驱体,采用CVD常压下简单快速实现了高密度高质量三维石墨烯宏观体(3D-GMOs)的制备,其制备过程见图3。利用3D-GMOs为电极对水溶液中的重金属离子进行快速高容量的电沉积,发现其对Cd2+,Pb2+,Cu2+,Ni2+的去除率随着电解沉积时间的增长而增大,吸附量分别为434,882,1 683,3 820 mg/g。值得一提的是,在反向电场作用下,3D-GMOs可以快速、高效的脱附被吸附的重金属离子(约1 min,脱附率>96%),进一步揭示了3D-GMOs在废水去除重金属离子方面潜在的重要应用。
|
|
|
图3 3D-GMOs制备过程示意图[42] |
Lei等[43]采用同样方法制备了GOF/Fe3O4纳米复合材料,并将其应用于水中Cr(Ⅳ)的去除。结果发现,由于该三维材料具有相互连通的多孔结构和较大的比表面积,吸附过程非常迅速,20 min内即达到了平衡状态。
综上可知,在初始吸附阶段,M2+的去除率和吸附量显著升高,达到某一时间段后,石墨烯及其复合材料对M2+的吸附速率逐渐趋缓,之后增长极其缓慢,最后趋于平衡。这主要是由于在吸附前期,石墨烯及其复合材料表面大量的吸附位点还没被占据,M2+得以快速吸附;随着吸附过程的进行,石墨烯基材料表面被越来越多的M2+占据,由于M2+分子之间的排斥力及吸附剂表面可利用吸附位点的减少,剩下的M2+不易被吸附,因此,吸附速率减慢,直至达到吸附平衡。
2.3 初始重金属离子浓度对吸附的影响
在实际生产中,废水中重金属离子的浓度往往是变化的,所以溶液的初始浓度对吸附性能的影响也是必须要考察的内容。Leng等[44]研究了初始重金属离子浓度对石墨烯吸附效果的影响,结果发现,去除率随Sb3+初始浓度的增大而减小,这说明Sb3+浓度较高时,应增加吸附剂用量才能达到较高的去除率。
杨熙等[45]的试验研究也证明了石墨烯对Cd2+的去除率随着初始浓度的增加而降低,但当Cd2+初始浓度由8 mg/L增加到40 mg/L时,其去除率仅由83%下降到69%,这说明对于高浓度的Cd2+溶液,石墨烯依旧具有良好的治理效果。换而言之,当水体中的重金属离子浓度偏高或是需要连续大量使用吸附剂进行吸附时,石墨烯仍可满足该种需求。
在吸附剂使用量一定的情况下,当重金属离子浓度较低时,相对于溶液中稀少的游离态金属离子,石墨烯的吸附位点并不能被填满,有着很大的空余量,导致去除率较高;随着初始重金属浓度的升高,所吸附的离子间存在排斥力,使重金属不能被进一步吸附,只能游离于溶液中,去除率下降。
2.4 温度对吸附的影响
温度是影响吸附的重要环境因子之一,对重金属的吸附-解吸、沉淀-溶解、氧化-还原等一系列化学和物理过程都有不同程度的影响。因此,温度的变化也可能导致吸附量的变化。一些文献表明[35],Zn2+在GO上的吸附是一个放热、自发进行的过程,低温下更加有利于吸附反应的进行,而有些文献则得出了相反的结论。Leng等[44]指出,温度的升高增多了吸附剂表面活性位点数量,增大了重金属离子的扩散速率,因此,石墨烯对Sb3+的去除率随温度的升高而增大,这与Zhao、Chandra、周峰等国内外学者的试验结论相一致[46-49]。
2.5 离子强度对吸附的影响
离子强度对吸附效果的影响主要包括对重金属离子本身存在形态及吸附剂表面吸附点位的影响,因此,不同金属离子受离子强度影响的结果也不尽相同。在实际吸附过程中,吸附量随离子强度的增大而增大、降低或基本不变的情况均有发生[28, 46,50-51]。
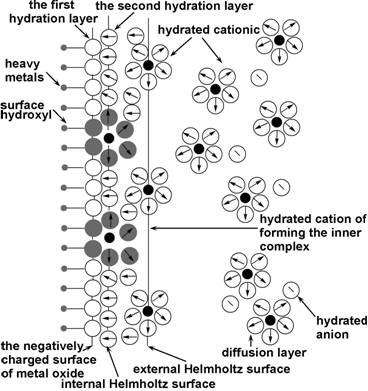
Sun等[51]研究发现,Eu3+在氧化石墨烯纳米薄片(GONS)上的吸附量几乎不受离子强度的影响,Zhao等[47, 52]在研究离子强度对GONS吸附Pb2+,Co2+,Cd2+的影响时,亦得出了一致的结果。石墨烯基材料吸附对离子强度不敏感,其原因可能是由于重金属阳离子与石墨烯及其复合材料表面含氧官能团形成了内层表面络合物[53],如图(图4)[56]。
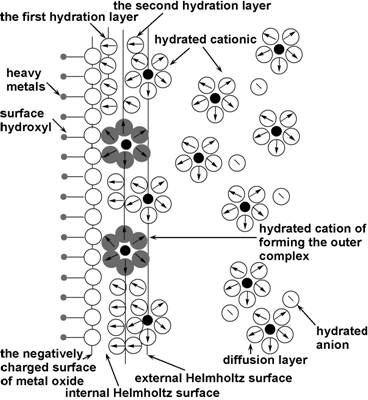
Wang、Hao等[35, 54]则发现GO及SiO2/石墨烯复合材料对重金属离子的吸附量随着离子强度的增加而减少,因此,他们认为重金属离子与石墨烯基材料表面官能团之间存在水分子,形成了外层表面络合物[55],如图(图5)[56]。
|
|
|
图4 内层表面络合物示意图[56] |
|
|
|
图5 外层表面络合物示意图[56] |
根据EDL(electrostatic double layer双层静电)理论,当溶液的离子强度增加时,吸附剂的双层静电被压缩,排斥作用减弱,有可能使吸附剂离子团聚,改变吸附剂的吸附总位点数,进而改变其对重金属离子的吸附剂。由此可见,离子强度既能影响到吸附质,又能影响到吸附剂,是影响吸附(物理或化学)很重要的一个因素。
3 石墨烯基材料的脱附再生
吸附能力和脱附能力是评估吸附剂吸附效果的两个最佳参数。理想的吸附剂不但应具有高效的吸附性能,能否循环再生也是衡量吸附剂实际应用性的一个重要标准。Wang等[35]采用0.1 mol/L HNO3、0.1 mol/L HCl、H2O对吸附Zn2+后的GO进行脱附研究,结果显示HNO3的脱附效果最好,脱附率高达91.6%。Leng等[61]选用了0.1 mol/L EDTA作脱附剂,洗脱吸附了Sb3+的石墨烯,由于EDTA自身易与重金属离子发生络合作用,因此脱附效果较好。随着洗脱次数、再吸附次数的增多,石墨烯对Sb3+的去除率降低,但五次吸附-脱附循环后,其去除率仍高达60%,相比于第一次吸附,仅降低20%左右。Deng等[31]选用低浓度(0.001 mol/L) EDTA为脱附剂,亦发现GNSPF6对Pb2+的第五次循环吸附率达75.23%。由此可见,石墨烯及其复合材料具有优异的循环吸附性能,经过多次循环使用后依然可以保持良好的吸附能力。
4 石墨烯及其复合材料对重金属的吸附机理
由于石墨烯和功能基团的多样性,以及重金属水溶液的化学复杂性,虽然已有大量关于石墨烯及其复合材料吸附重金属离子的研究工作,但至今仍没有一个完整、详细、明确的吸附机理体系。对于石墨烯基材料去除重金属离子的机理,文献报道主要有:离子交换作用、表面络合作用、吸附作用和静电相互作用[31,57]。以上这几种吸附作用并不是孤立的,往往相伴产生。通常情况下,吸附强烈依赖于吸附剂的孔隙结构和比表面面积,因此,重金属离子的吸收很大程度上归因于吸附剂表面特定吸附位点的离子交换或化学吸附。
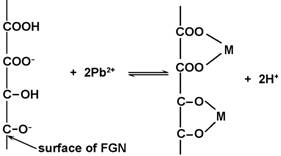
对于Pb2+,Cu2+,Co2+等二价重金属阳离子的去除机理,目前一般认为是M2+与石墨烯基材料表面的含氧官能团之间进行了表面络合反应,在石墨烯表面形成复杂、稳定的络合物[52, 58-59],如图6所示。
|
|
|
图6 二价重金属阳离子在石墨烯基材料表面的络合反应 |
5 结论与展望
石墨烯及其复合材料可以吸附水中众多的重金属离子,且吸附量大、速度快、效率高,其优良的吸附性能源自于巨大的表面积、发达的内部微孔结构和丰富的表面官能团。从目前的研究来看,石墨烯基材料在水处理应用领域中最主要的突破在于材料、化学和环境治理的交叉研究。然而,为了更深入地了解石墨烯基材料对重金属离子吸附的物理化学本质和机理,今后可以在以下几方面进行研究:
(1) 对石墨烯及其复合材料去除机理部分仍缺乏深入的探讨。目前所提出的几种重金属离子去除机理,对于具体哪种起决定作用仍缺乏深层次的理论和实验依据的支撑作用。
(2) 有关石墨烯基材料脱附的研究报道较少,其中脱附剂种类少和脱附效率低是存在的主要问题,另外,除文中涉及的几种重金属离子外,也可对吸附其它重金属离子后的石墨烯基材料进行脱附研究,并进一步考察温度、离子强度、初始离子浓度等对脱附的影响。
(3) 目前多数研究还仅集中在石墨烯基材料对单一重金属离子的吸附研究,而石墨烯基材料对多种金属离子共存时的吸附研究则少见于文献中。因此,石墨烯基材料的竞争吸附性能也有着重要的现实意义。
(4) 小片层的石墨烯在实际中难以操控,因此基于石墨烯的结构组装形成宏观体是石墨烯走向实际应用的重要步骤。但是,石墨烯基宏观体研究还处于初级阶段,要实现实际应用,还有很多需要改进的地方,如现有方法制备的石墨烯宏观体的性能还很难满足实际应用,性能更好的石墨烯基组装体有待进一步开发。
参考文献:
[1] Huang X, Sillanpää M, Duo B U, et al. Water quality in the tibetan plateau: metal contents of four selected rivers[J]. Environmental Pollution, 2008, 156(2): 270-277.
[2] Simonovic S P. World water dynamics: global modeling of water resources[J]. Journal of Environmental Management, 2002, 66(3): 249-267.
[3] Meng Xianghe,Hu Guofei. Heavy metal wastewater treatment[M]. Beijing: Kluwer Academic Publishers, 2000: 20-25.
孟样和,胡国飞. 重金属废水处理[M].北京:化学工业出版社,2000:20-25.
[4] Kobya M, Demirbas E, Senturk E, et al. Adsorption of heavy metal ions from aqueous solutions by activated carbon prepared from apricot stone[J]. Bioresource Technology, 2005, 96(13): 1518-1521.
[5] Yanagisawa H, Matsumoto Y, Machida M. Adsorption of Zn(Ⅱ) and Cd(Ⅱ) ions onto magnesium and activated carbon composite in aqueous solution[J]. Applied Surface Science, 2010, 256(6): 1619-1623.
[6] Zheng Jingtang,Zhang Yinzhi,Wang Maozhang. The studyprogressandprospectof porous carbonmaterials[J]. Progress in Chemistry, 1996, 8(3): 241-250.
郑经堂,张引枝,王茂章.多孔炭材料的研究进展及前景[J].化学进展,1996,8(3):241-250.
[7] Stafiej A, Pyrzynska K. Adsorption of heavy metal ions with carbon nanotubes[J]. Separation and Purification Technology, 2007, 58(1): 49-52.
[8] Li Y, Ding J, Luan Z, et al. Competitive adsorption of Pb2+, Cu2+ and Cd2+ ions from aqueous solutions by multiwalled carbon nanotubes[J]. Carbon, 2003, 41(14): 2787-2792.
[9] Wang Yanxin,GuoYonglong,Yang Zhihua, et al.Thestudy of heavy metals removal in water by using zeolite synthesized with fly ash[J]. Science in China(Series D), 2003, 33(7): 636-643.
王焰新,郭永龙,杨志华,等.利用粉煤灰合成沸石及其去除水中重金属的实验研究[J].中国科学(D辑),2003,33(7):636-643.
[10] Repo E, Warchol J K, Kurniawan T A, et al. Adsorption of Co(Ⅱ) and Ni(Ⅱ) by EDTA-and/or DTPA-modified chitosan: kinetic and equilibrium modeling[J]. Chemical Engineering Journal, 2010, 161(1): 73-82.
[11] Ma Ning, Wang Qin, Sun Shengling, et al. Progress in chemical modification of chitin and chitosan[J]. Progress in Chemistry,2004, 16(4): 643-653.
马 宁,汪 琴,孙胜玲,等.甲壳素和壳聚糖化学改性研究进展[J].化学进展,2004,16(4):643-653.
[12] Luo Daocheng, Yi Pinggui, Chen Anguo, et al. Adsorption of Pb+2, Cu+2, Zn+2 and Cr+3 in electroraating wastewater usinghumic acid resin[J]. Materials Protection, 2002, 35(4): 54-56.
罗道成,易平贵,陈安国,等.腐植酸树脂对电镀废水中重金属离子的吸附[J].材料保护,2002,35(4):54-56.
[13] Lou Song, Liu Yongfeng, Bai Qingqing, et al. Adsorption mechanism of macroporousadsorption resins[J]. Progress in Chemistry,2012,24(08): 1427-1436.
娄 嵩,刘永峰,白清清,等.大孔吸附树脂的吸附机理[J].化学进展,2012,24(08): 1427-1436.
[14] Li D, Kaner R B. Graphene-based materials[J]. Nat Nanotechnol, 2008, 3(320): 1170-1171.
[15] Stankovich S, Dikin D A, Dommett G H, et al. Graphene-based composite materials[J]. Nature, 2006, 442(7100): 282-286.
[16] Geim A K, Novoselov K S. The rise of graphene[J]. Nature Materials, 2007, 6(3): 183-191.
[17] Wu Jiangbin.Graphene-the most promising "miracle material"[J]. PhysicsBulletin, 2009, 6:1.
吴江滨.最具潜力的新型“奇迹材料”—石墨烯[J].物理通报,2009,6:1.
[18] Wei Zhiyong, Bi Kedong, Chen Yunfei.Thermal conductivity of graphene nanoribbons simulated by molecular dynamics[J].Jouranal of Southeast University (Natural Science Edition), 2010, 40(002): 306-310.
魏志勇,毕可东,陈云飞.石墨烯纳米带热导率的分子动力学模拟[J].东南大学学报:自然科学版,2010,40(002):306-310.
[19] Van Noorden R. Moving towards a graphene world[J]. Nature, 2006, 442(7100): 228-229.
[20] Brodie B C. Sur le poidsatomique du graphite[J]. Ann Chim Phys, 1860, 59(466):472.
[21] Staudenmaier L. Verfahrenzurdarstellung der graphitsäure[J]. Berichte der Deutschen Chemischen Gesellschaft, 1898, 31(2): 1481-1487.
[22] Hummers Jr W S, Offeman R E. Preparation of graphitic oxide[J]. Journal of the American Chemical Society, 1958, 80(6): 1339.
[23] Huang X, Qi X, Boey F, et al. Graphene-based composites[J]. Chemical Society Reviews, 2012, 41(2): 666-686.
[24] Feng Dongyan, Sun Yiran, Yu Fei, et al. Adsorption properties of graphene and its composites for heavy metal ions in aqueous solution[J]. Journal of Functional Materials, 2015,46(3): 3009-3015
冯冬燕,孙怡然,于 飞,等. 石墨烯及其复合材料对水中重金属离子的吸附性能研究[J].功能材料,2015,46(3): 3009-3015.
[25] Bulgariu L, Bulgariu D, Malutan T, et al. Adsorption of lead(Ⅱ) Ions from aqueous solution onto lignin[J]. Adsorption Science & Technology, 2009, 27(4): 435-445.
[26] Yang S T, Chang Y L, Wang H F, et al. Folding/aggregation of graphene oxide and its application in Cu2+ removal[J]. Journal of Colloid and Interface Science, 2010, 351(1): 122-127.
[27] Deng J H, Zhang X R, Zeng G M, et al. Simultaneous removal of Cd(Ⅱ) and ionic dyes from aqueous solution using magnetic graphene oxide nanocomposite as an adsorbent[J]. Chemical Engineering Journal, 2013, 226: 189-200.
[28] Hao L Y, Song H J, Zhang L C, et al. SiO2/graphene composite for highly selective adsorption of Pb(Ⅱ) ion[J]. Journal of Colloid and Interface Science, 2012, 369: 381-387.
[29] He Y Q, Zhang N N, Gong Q J, et al. Metal nanoparticles supported graphene oxide 3D porous monoliths and their excellent catalytic activity[J]. Materials Chemistry Physics, 2012, 134(2-3): 585-589.
[30] Madadrang C J, Kim H Y, Gao G H, et al. Adsorption behavior of EDTA-graphene oxide for Pb(Ⅱ) removal[J]. ACS Applied Materials & Interfaces, 2012, 4(3): 1186-1193.
[31] Deng X J, Lu L L, Li H W, et al. The adsorption properties of Pb(Ⅱ) and Cd(Ⅱ) on functionalized graphene prepared by electrolysis method[J]. Journal of Hazardous Materials, 2010, 183(1-3): 923-930.
[32] Zhao G, Li J, Ren X, et al. Few-layered graphene oxide nanosheets as superior sorbents for heavy metal ion pollution management[J]. Environmental Science & Technology, 2011, 45(24): 10454-10462.
[33] Chandra V, Kim K S. Highly selective adsorption of Hg2+ by a polypyrrole-reduced graphene oxide composite[J]. Chemical Communications, 2011, 47(13): 3942-3944.
[34] Ma H, Zhang Y, Hu Q, et al. Chemical reduction and removal of Cr(Ⅵ) from acidic aqueous solution by ethylenediamine-reduced graphene oxide[J]. J. Mater. Chem, 2012, 22(13): 5914-5916.
[35] Wang H, Yuan X, Wu Y, et al. Adsorption characteristics and behaviors of graphene oxide for Zn(Ⅱ) removal from aqueous solution[J]. Applied Surface Science, 2013, 279: 432-440.
[36] Wu W, Yang Y, Zhou H, et al. Highly efficient removal of Cu(Ⅱ) from aqueous solution by using graphene oxide[J]. Water, Air, & Soil Pollution, 2013, 224(1): 1-8.
[37] Arias F, Sen T K. Removal of zinc metal ion (Zn2+) from its aqueous solution by kaolin clay mineral: a kinetic and equilibrium study[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2009, 348(1): 100-108.
[38] Sen T K, Gomez D. Adsorption of zinc (Zn2+) from aqueous solution on natural bentonite[J]. Desalination, 2011, 267(2): 286-294.
[39] Repo E, Warchol J K, Kurniawan T A, et al. Adsorption of Co (Ⅱ) and Ni (Ⅱ) by EDTA-and/or DTPA-modified chitosan: kinetic and equilibrium modeling[J]. Chemical Engineering Journal, 2010, 161(1): 73-82.
[40] Moradi O, Zare K. Adsorption of Pb(Ⅱ), Cd(Ⅱ) and Cu(Ⅱ) ions in aqueous solution on SWCNTs and SWCNT-COOH surfaces: kinetics studies[J]. Fullerenes, Nanotubes and Carbon Nanostructures, 2011, 19(7): 628-652.
[41] Pyrzynska K. Sorption of Cd (Ⅱ) onto carbon-based materials-a comparative study[J]. Microchimicaacta, 2010, 169(1-2): 7-13.
[42] Li W, Gao S, Wu L, et al. High-density three-dimension graphene macroscopic objects for high-capacity removal of heavy metal ions[J]. Scientific Reports, 2013, 3:1-6.
[43] Lei Y, Chen F, Luo Y, et al. Three-dimensional magnetic graphene oxide foam/Fe3O4 nanocomposite as an efficient absorbent for Cr (Ⅵ) removal[J]. Journal of Materials Science, 2014, 49(12): 4236-4245.
[44] Leng Y, Guo W, Su S, et al. Removal of antimony (Ⅲ) from aqueous solution by graphene as an adsorbent[J]. Chemical Engineering Journal, 2012, 211: 406-411.
[45] Yang Xi. Preparation of graphene oxide and graphene nanomaterials and their application in heavy metal ions removal[D]. Central China Normal University,2012.
杨 熙.氧化石墨烯和石墨烯纳米材料制备及其重金属吸附性能研究[D].武汉:华中师范大学, 2012.
[46] Chandra V, Park J, Chun Y, et al. Water-dispersible magnetite-reduced graphene oxide composites for arsenic removal[J]. Acs Nano, 2010, 4(7): 3979-3986.
[47] Zhao G X, Ren X M, Gao X, et al. Removal of Pb(Ⅱ) ions from aqueous solutions on few-layered graphene oxide nanosheets[J]. Dalton Transactions, 2011, 40(41): 10945-10952.
[48] Zhou Feng, Wan Xin, Fu Yingqing. Synthesis and adsorption properties of graphene by reduction of graphite oxide[J]. Journal of Shenzhen University Science and Engineering, 2011, 28(5): 436-439.
周 锋,万 欣,傅迎庆.氧化石墨还原法制备石墨烯及其吸附性能[J].深圳大学学报(理工版), 2011, 28(5):436-439.
[49] Zhang Huangjing. Application of graphene composite in wastewater treatment with Hg[J]. Journal of Minxi Vocational and Technical School, 2011, 13(2): 115-120.
张景煌.石墨烯复合物在含Hg废水处理中的应用研究[J].闽西职业技术学院学报,2011, 13(2):115-120.
[50] Liu M C, Chen C L, Hu J, et al. Synthesis of magnetite/graphene oxide composite and application for cobalt(Ⅱ) removal[J]. Journal of Physical Chemistry C, 2011, 115(51): 25234-25240.
[51] Sun Y B, Wang Q, Chen C L, et al. Interaction between Eu(Ⅲ) and graphene oxide nanosheets investigated by batch and extended X-ray absorption fine structure spectroscopy and by modeling techniques[J]. Environmental Science & Technology, 2012, 46(11): 6020-6027.
[52] Zhao G, Li J, Ren X, et al. Few-layered graphene oxide nanosheets as superior sorbents for heavy metal ion pollution management[J]. Environmental Science & Technology, 2011, 45(24): 10454-10462.
[53] Goldberg S. Inconsistency in the triple layer model description of ionic strength dependent boron adsorption[J]. Journal of Colloid and Interface Science, 2005, 285(2): 509-517.
[54] Hao L, Song H, Zhang L, et al. SiO2/graphene composite for highly selective adsorption of Pb(Ⅱ) ion[J]. Journal of Colloid and Interface Science, 2012,369(1): 381-387.
[55] Lützenkirchen J. Ionic strength effects on cation sorption to oxides: macroscopic observations and their significance in microscopic interpretation[J]. Journal of Colloid and Interface Science, 1997, 195(1): 149-155.
[56] Wu Zhijian, Liu Haining, Zhang Huifang. Research progress on mechanisms about the effect of ionic strength on adsorption[J]. Environmental Chemistry, 2010,29(6): 997-1003.
吴志坚,刘海宁,张慧芳.离子强度对吸附影响机理的研究进展[J].环境化学,2010,29(6): 997-1003.
[57] Zhang N, Qiu H, Si Y, et al. Fabrication of highly porous biodegradable monoliths strengthened by graphene oxide and their adsorption of metal ions[J]. Carbon, 2011, 49(3): 827-837.
[58] Yang S, Chang Y, Wang H, et al. Folding/aggregation of graphene oxide and its application in Cu2+ removal[J]. Journal of Colloid and Interface Science, 2010, 351(1): 122-127.
[59] Laszlo K, Podkoscielny P, Dabrowski A. Heterogeneity of polymer-based active carbons in adsorption of aqueous solutions of phenol and 2, 3, 4-trichlorophenol[J]. Langmuir, 2003, 19(13): 5287-5294.