石墨烯健康风险研究现状及展望*
yd19417
孙寒1) 冯雷雨1, 2)** 陈银广1)** 1) 同济大学环境科学与工程学院,污染控制与资源化研究国家重点实验室,上海200092;2) 江苏盐城环保产业工程研发服务中心,盐城224051
收稿日期:2014-04-30,接受日期:2014-09-28
* 国家自然科学基金(51108332)和江苏省自然科学基金(BK2011416)资助项目.
** 通讯联系人. Tel: 021-65981263;冯雷雨. E-mail: leiyufeng@tongji.edu.cn;陈银广. E-mail: yinguangchen@yahoo.com
原载:生物化学与生物物理进展2015, 42(1): 5-15
【摘要】石墨烯是一种新型的二维碳纳米材料,由于具有优异的电子、光学、机械等特性,已经被广泛应用于电子器件、复合材料、能源储存等领域。近年来,石墨烯在生物医药领域崭露头角,其在诸如生物传感器、细胞成像、药物输运、抗菌材料等方面的广泛应用,为生物医药技术带来了突破,也为人体健康带来了福音。然而,随着石墨烯以不同途径进入人们的生活,其对人体及其他生物体的安全构成潜在威胁,引发的健康风险正受到广泛关注。本文从石墨烯对生物体的影响及其同生物体的相互作用方面入手,综述了近年来石墨烯健康风险的研究进展,并且总结归纳了人体抵御石墨烯健康风险的途径及机制,最后指出了未来石墨烯健康风险方面的研究方向。
【关键词】石墨烯,生物体,相互作用,健康风险,生物医药,毒理学
【学科分类号】Q5,R54 DOI: 10.3724/SP.J.1206.2014.00112
1 新兴碳纳米材料——石墨烯
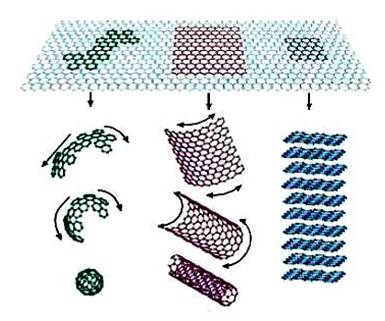
纳米科学是21 世纪最重要的科学领域之一,纳米材料的不断研发为物理、化学、医学以及环境等诸多领域带来了革命性的影响[1]。然而,随着纳米材料的应用范围越来越广,其在环境中暴露量增大进而引发的环境效应和健康风险越来越引发科学界的重视。作为一种新兴的非金属纳米材料,石墨烯具有独特的结构和性质,引起了更加广泛的关注(图1)。同时,由于石墨烯易于修饰,出现了多种重要的石墨烯衍生物[2-4]。
|
|
|
图1 石墨烯结构简图 |
自2004 年石墨烯被发现以来,针对石墨烯及其衍生物的研究探索已经取得了长足的进步,研究成果广泛用于能源、环境等诸多领域,在电化学设备、能量存储、催化反应、细胞成像、药物输送、污染物去除、化学生物及环境样品提取等方面应用广泛[5-7]。2008 年以后,石墨烯开始在生物医药领域崭露头角,例如,它可以作为细胞生长支架,同多糖等物质合成与细胞高度相容的复合材料,植入人体,经过功能化的纳米石墨烯还可以作为有效载体将用于化疗的抗癌药物运输到细胞中,提高治疗效果和效率[8]。此外,基于石墨烯的生物传感器可以很好地检测各种生物分子。总之,石墨烯在生物检测、肿瘤治疗以及细胞成像等方面的应用,填补了部分生物医药技术的空白,为推动生物医药行业的发展起到了不可忽视的作用。然而,也正是由于石墨烯及其衍生物相关纳米材料的广泛应用,在环境中与人体内存在不同程度的暴露,加大了人体及其他生物体同这些纳米材料的接触机会,从而对环境及生物体产生潜在的生态和健康风险[9],由此引发的关于纳米材料生物安全性方面的问题逐渐浮出水面,相关研究也正如火如荼地进行。
基于此,本文从石墨烯对生物体健康的影响及其在不同水平上(有机小分子、蛋白质、细胞以及器官)同生物体相互作用和化学机制方面综述了石墨烯健康风险的研究进展,同时归纳了机体应对石墨烯影响的防御体系,最后指出了未来关于石墨烯健康风险方面的研究方向。
2 石墨烯对人体健康的潜在风险
2.1 石墨烯入侵:从细菌到人体
富勒烯和碳纳米管等碳纳米材料的生物毒性已经研究了多年。作为富勒烯和碳纳米管等重要碳纳米材料母体的石墨烯其生物毒性研究尤其引发关注。2010 年,伊朗科学家率先发现将大肠杆菌和金黄色葡萄球菌暴露在石墨烯中,通过石墨烯对细胞膜的接触破坏,可以引起菌体死亡的现象,从此揭开了石墨烯毒性研究的序幕[10]。随后,研究方向集中在石墨烯的抑菌机理方面。从最初发现的石墨烯对细菌的物理穿刺破坏,到后来发现石墨烯对细菌细胞可以产生氧化胁迫作用[11],再到2013 年,通过分子模拟技术发现,石墨烯可以抽取细胞膜的重要组分磷脂(phospholipid),导致细胞解体这一新机制[12],随着生物化学新技术的不断引进,石墨烯杀菌及其机理的研究正在不断加深。
随着石墨烯对细菌细胞产生毒性的认识越来越清晰,石墨烯是否会对人体产生影响这一疑问逐渐进入人们的视野。在此疑问的激发下,科学家们通过研究发现,石墨烯及其复合材料可以对人体皮肤成纤维细胞以及血红细胞产生细胞毒性,毒性大小因石墨烯浓度以及同细胞相互作用方式的不同而存在差异,但均已表明石墨烯对人体存在潜在的健康风险[13]。因此,为了更加系统地研究石墨烯对人体的健康风险,阐明石墨烯对生物体的影响显然十分重要。
2.2 石墨烯在不同水平上同生物体的相互作用
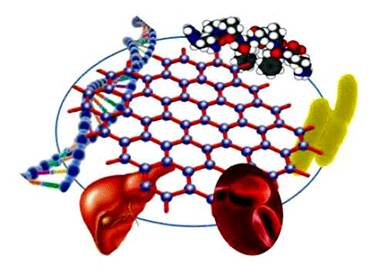
通常情况下,石墨烯对生物体的影响主要是通过与生物体密切相关的单质、化合物以及生物大分子之间的相互作用实现的(图2)。
|
|
|
图2 石墨烯与生物体相互作用示意图 |
研究石墨烯对人体及其他生物体的健康风险,阐明其与生物之间相互作用的方式和机制具有重大意义,也会为将来设计对人体更加安全的石墨烯产品奠定坚实的基础.
2.2.1 石墨烯与DNA
DNA 是引导生物发育与生命机能运作的重要物质,组成单位称为四种脱氧核苷酸(碱基)。石墨烯同DNA 的相互作用会直接影响生物体的生存发育,对人体健康的意义极为重大。有研究发现,石墨烯同DNA 作用时,主要作用对象是其碱基。DNA 由A-T,G-C 两种碱基对组成,其中,A-T比G-C 更加容易同石墨烯产生相互作用[14]。一般情况下,DNA 分子在石墨烯表面发生聚集后可以形成不同的聚集形态,产生不同聚集形态的原因是由于碱基- 碱基之间的π-π 堆积作用以及碱基- 石墨烯相互作用之间产生的竞争[15]。氢键、π-π 堆积以及溶剂化作用的共同影响使得石墨烯与碱基之间达到热动力学平衡[16]。DNA 链的长短也可影响其与石墨烯相互作用,相对长链DNA,短链DNA 更容易吸附在石墨烯表面,并且与石墨烯结合得更紧密,酸性环境和高离子强度有利于它们之间的吸附结合[17]。另外,通过加入cDNA、互补碱基序列或者表面活性剂,可以使DNA 从石墨烯上脱附,但是温度对DNA 的脱附并没有显著影响[17-19]。到目前为止,石墨烯与DNA 分子之间的作用研究大多停留在体外或人工条件下进行,而在生物体内同核酸分子作用时石墨烯所表现出的行为应更为复杂。此外,DNA 分子还可以在石墨烯上进行自组装。DNA 链的长度以及石墨烯的化学修饰对DNA在石墨烯上的自组装有较为显著的影响。具有12个碱基对以下的短链DNA 在石墨烯上可以发生稳定的自组装过程,形成石墨烯-DNA 结合物(graphene-DNA hybrid)[14]。不经任何化学修饰的纯石墨烯无法对短链DNA 进行捕捉,但是用这种石墨烯-DNA 结合物却可以捕捉短链DNA。有趣的是,石墨烯的重要衍生物氧化石墨烯可以在一定离子强度的溶液中同短链DNA 形成较为稳定的络合物,起到捕集作用的可能是氧化石墨烯表面丰富的含氧基团,加入非离子型表面活性剂可以阻碍络合物的生成[19]。
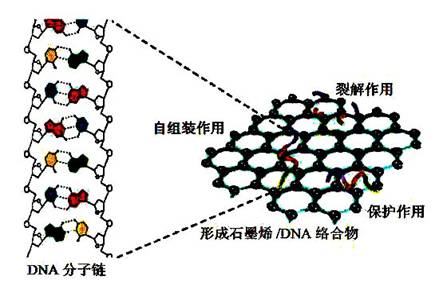
石墨烯及其衍生物同DNA 分子形成的络合物具有某些特殊的性质。例如,氧化石墨烯与DNA形成复合物后可以有效阻止DNA 被酶解[17],说明氧化石墨烯对DNA 起到了保护作用,而这种保护作用可以在生物医药领域有所应用。比如药物在细胞内释放过程中,氧化石墨烯则可以充当“保护伞”,降低药物对DNA 的破坏风险[20]。石墨烯对DNA 的保护机制可分为直接保护和间接保护两种。直接保护是利用石墨烯同DNA 形成复合体后增大了核酸酶(DNase)与DNA 接触的空间位阻,使得核酸酶难以同DNA 结合发生酶解反应。间接保护则是利用石墨烯抑制核酸酶的活性,从而保护DNA 免受伤害。与保护作用相反,在一定条件下石墨烯可以对DNA 起到破坏作用,例如,有报道指出,在和金属Cu 共存的情况下氧化石墨烯可以对DNA 进行剪切破坏,从而使得DNA 链发生断裂(DNA cleavage)。此外,氧化石墨烯- 金属复合物的氧化作用也可以造成DNA 损坏[21]。总之,DNA 和石墨烯之间的作用既有两者之间的堆积与竞争,又有两者之间的络合与保护,所表现出来的行为十分复杂(图3)。
|
|
|
图3 石墨烯和DNA 分子作用示意图 |
2.2.2 石墨烯与蛋白质
蛋白质由氨基酸脱水缩合形成,在细胞和生物体基因表达的调节、细胞中氧化还原、电子传递、神经传递及学习和记忆等多种生命活动过程中,起着十分重要的作用。生物的结构和性状都与蛋白质有关。石墨烯同蛋白质、氨基酸以及多肽均有着复杂的相互作用。在石墨烯和蛋白质相互作用中起到主导作用的是静电引力和范德华力。对氧化石墨烯而言,其与蛋白质之间的相互作用主要依靠氧化石墨烯表面的含氧官能团同蛋白质含氮/ 氧基团之间发生作用[22]。另外,多肽链与石墨烯可以形成多肽石墨烯复合物,形成过程受到外界条件的影响,酸性与中性环境有利于复合物的生成,其次水溶液中的电荷也会有所影响。
蛋白质在与石墨烯作用时,根据环境条件的不同其作用位点也会发生变化。通常条件下,石墨烯具有二维平面结构,同蛋白质发生作用的空间场所主要分布于石墨烯的边位和表面上。多肽链优先选择聚集在纳米石墨烯薄片的边缘部位,而非薄片表面之上,并且通过对两者相互作用时的能量变化进行分析,位于边位的多肽链同石墨烯的相互作用能为-458kJ/mol,比表面位置上与多肽的相互作用能(-622kJ/mol)要弱,这表明促使多肽链和石墨烯在边位结合的主要因素是静电引力,而促使多肽链聚集在石墨烯薄片表面的因素是π-π 堆积作用[23]。此外,蛋白质在石墨烯上聚集位置也受到环境pH 值的影响。酸性条件下,蛋白质主要聚集在石墨烯表面而非聚集在其边缘位置;碱性条件下则相反。由此可见,蛋白质和石墨烯相互作用时,蛋白质的空间分布会根据环境条件的不同而相应地发生变化,这对解释石墨烯在体内和生态系统中的行为具有重要意义。
值得注意的是,石墨烯同蛋白质作用是相互的,蛋白质的性质及石墨烯本身的理化性质也会在作用中产生一些变化。例如,石墨烯的分布以及其毒性会发生变化[24]。纯石墨烯表面没有亲水基团,因此其水溶性很差,而经过多聚-L- 赖氨酸修饰的石墨烯有很好的水分散性,并且具有很好的生物相容性[25]。
然而,目前为止,石墨烯和蛋白质的复合物超结构分析起来十分复杂,需要通过实验手段结合计算机模拟方法进一步加以探索。当石墨烯插入蛋白质的疏水核心后会形成稳定的复合物,但是与此同时石墨烯的这一行为也会干扰蛋白质的活性位点,最终可能导致蛋白质功能损坏,进而导致由相关蛋白质代谢过程发生紊乱,引起机体病变。因此,尽管在石墨烯和蛋白质相互作用的特征和机制方面有着极为有限的认识,但不可否认的是,蛋白质在人体健康和石墨烯的环境风险方面有着不可估量的影响,仍然需要进一步研究和认识。
2.2.3 石墨烯与酶
与DNA 分子、蛋白质分子类似,石墨烯同酶分子也有着丰富的相互作用。酶作为生物体内具有催化功能的生物大分子,其性质的变化将直接影响机体新陈代谢的正常进行。因此,石墨烯同酶的相互作用同样引人关注。已有文献报道,氧化石墨烯表面具有各种类型的官能团,这些官能团非常容易同酶的胺基残键结合形成胺共价键,这也构成了氧化石墨烯同酶可以发生反应的重要化学基础[26]。不同的酶在与石墨烯发生反应后其性质会有所变化。例如,经过氧化石墨烯修饰的酶在热稳定性上有明显提升,并且这些酶可以在更大的pH 范围内保持活性,这一相互作用的特点可以应用于生物传感器、医药以及污水处理领域[27]。氧化石墨烯在分子氧存在的条件下可以形成某些表面中间体(surface intermediates),进而可以氧化谷胱甘肽(GSH)形成谷胱甘肽二聚体(dimer glutathione),以及其他弱氧化产物。由于GSH 是人体内重要的抗氧化剂和自由基清除剂,因此,这势必会影响GSH 在人体内的功能[28]。此外,氧化石墨烯还可以作为人工受体并且抑制胰凝乳蛋白酶的活性,原因就在于前者具有的超大的质量比表面积,而后者受到憎水、带负电以及芳香性基团这些性质共同的影响[29]。酶和氧化石墨烯的相互作用是可逆的,这种相互作用不会引起氧化石墨烯结构发生变化。值得注意的是,氧化石墨烯和酶结合后的活性位点仍旧存在,这也保证了其他任意的酶和蛋白质能够继续与氧化石墨烯发生作用。
有趣的是,经过某些功能化的石墨烯也具有酶的化学性质和特点。例如,经过叶酸(folic acid)功能化的石墨烯就具有过氧化酶的性质,其催化效果受到pH、温度、过氧化氢浓度的影响,这与辣根过氧化酶(horseradish peroxidase)极其类似[30-31]。有报道指出,酶的催化过程可以在氧化石墨烯表面产生纳米级空洞(nanohole),这些空洞的存在有助于增加含氧官能团的数量[32]。相比于纯石墨烯,酶的催化活性位点的特性更接近于氧化石墨烯,因此氧化石墨烯的催化效果就更胜于石墨烯[33]。假如石墨烯具有同酶类似的催化作用,可被用于污水处理领域,还可以用于人体或者其他生物体内阻碍还原系统的功能。此外,氧化石墨烯还可以促进量子点的生成并且激发ROS 产生[34],这些均是对人体健康和生态系统有潜在危害的一类副产物。总之,石墨烯同酶可以产生丰富的相互作用,这些作用可能影响酶的活性进而导致机体代谢系统紊乱;另一方面,利用这种相互作用来改造酶的性质,使其发挥有利的作用也是今后值得关注的方向。
2.2.4 石墨烯与细胞
细胞是生物体结构和功能的基本单位,也是使核酸分子、蛋白质等生物分子发挥其功能的重要载体,因此石墨烯同细胞的作用自然不可忽视。石墨烯和氧化石墨烯的特殊结构,使其在与细胞进行相互作用时,能够影响细胞的形态、移动性能、黏附性以及细胞增殖等一系列特性[35-36],在这种相互作用中,有些可以为细胞带来积极的影响,但有些作用则可能会破坏细胞,对细胞产生负面的影响。
在积极影响方面,首先,石墨烯可作为某些细胞的载体,对细胞的生殖分化产生影响。例如,石墨烯能够为小鼠成纤维母细胞系的附着提供良好载体,其细胞系可以在石墨烯上较好地增殖。类似的,L929 细胞可以黏附在石墨烯- 壳聚糖复合物膜上并且很好地增殖,细胞经过检测并未出现毒性反应,细胞形态也没有明显变化[37]。经还原的氧化石墨烯(RGO)对神经内分泌PC12 细胞、少突胶质细胞具有良好的生物相容性,并且发现在RGO 上细胞生长增殖较好,且保持原有形态,没有出现任何细胞溶解或遭到破坏的现象[38]。分析原因,氧化石墨烯之所以能够使细胞黏附在其表面的原因主要是其具有丰富的含氧官能团[39]。
其次,经某些有机或无机分子修饰的石墨烯与生物体的相容性得到了明显提升。例如,人工合成过氧化物酶或者细胞外基质蛋白可以促进细胞同石墨烯之间的相互作用。经壳聚糖包被的氧化石墨烯可以有效阻止细胞溶血[13]。四氧化三铁与氧化石墨烯形成的复合物具有很高的生理学稳定性,并且不具有细胞毒性,能够在体内和细胞很好的相容[40]。经过碳酸钙化学修饰的石墨烯或者氧化石墨烯为成骨细胞的附着和生长提供了一个与体内环境相似的微环境,并且细胞的成活率很高[41]。石墨烯与人体的相容性这一特殊性质将可以广泛的应用于医药领域。
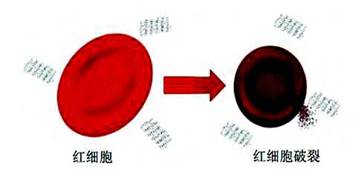
除了为细胞带来积极作用以外,石墨烯产生的负面作用也不可小觑。有报道指出,石墨烯可以与人体血红细胞产生强烈相互作用,导致细胞破裂,对人体健康造成极大威胁(图4)[13]。
|
|
|
图4 石墨烯破坏人体血红细胞 |
石墨烯的细胞毒性与培养时间、温度、溶解介质密切相关。此外,氧化石墨烯的浓度以及自身的尺寸也同样影响其自身对细胞的毒性,例如,在一定的浓度范围内,氧化石墨烯不会对A549 细胞的形态、活性以及膜整体性方面造成损害[42]。不同尺寸的石墨烯材料对细胞的物理穿刺破坏的程度也不尽相同。到目前为止,石墨烯进入细胞的机制还没有系统的解释。由于细胞在石墨烯上的附着同温度没有明显的关系,因此石墨烯进入细胞体内的方式可能是直接作用于细胞表面,以物理性穿刺,而不是通过某些依靠能量的方式进入细胞。近年来的研究还发现,石墨烯可以通过其他一些特殊的方式进入细胞,并且依据细胞的不同,其进入方式不同。例如,氧化石墨烯和明胶形成的纳米复合物膜可以通过一种非特异性的内吞作用被MCF-7 细胞吸收[43]。
除了物理穿刺破坏以外,氧化行为损坏细胞也是石墨烯细胞毒性的一种普遍体现。纯石墨烯可以影响线粒体膜电位,增加胞内ROS 含量,通过激发线粒体机制(激活信号蛋白)导致细胞凋亡[44]。氧化石墨烯的细胞毒性也可表现在其能够与细胞直接作用,物理性破坏细胞膜导致细胞解体[45]。导致细胞膜损坏的原因则很可能是石墨烯基团所带负电荷同带正电荷的细胞膜磷脂酰胆碱之间发生强烈的静电作用。目前,归纳起来可能存在的石墨烯引起的细胞毒性机理为:a、石墨烯同细胞表面相接触并向细胞发出刺激信号,信号在细胞内传导至细胞核调控中心,随即对相关基因和蛋白质进行调节,最后导致细胞分离、萎缩等变化[46];b、石墨烯进入细胞质后会对溶酶体、线粒体、内质以及细胞核造成干扰,从而破坏细胞正常代谢过程以及基因转录等重要行为,最终导致细胞凋亡[36]。
2.2.5 石墨烯与组织器官
石墨烯可以通过不同途径进入人体组织器官中,进而对其产生负面影响。血液作为人体重要的循环系统,恰好为石墨烯提供了一个很好的运输载体。与其他碳纳米材料相比,氧化石墨烯在血液中停留时间较长,其半衰期达到5.3 h,并且它在网状内皮组织中的吸收率很低[47]。然而,某些功能化的石墨烯却可以被组织器官很好地吸收。例如,经过葡聚糖化学修饰后的氧化石墨烯形成的GO/ 葡聚糖复合物再经静脉注射之后,可分布在网状内皮组织中,如肝脏和脾脏[48]。通常情况下,石墨烯在体内的分布固然与其注射剂量有联系,但是最重要的影响因素却是体内的暴露时间和对其进行的化学修饰。主要是因为暴露时间会影响石墨烯在体内的转移和分布,而化学修饰则会改变石墨烯的原有性质,从而影响其在体内的降解。
石墨烯及其功能化合物在人体各组织器官中的分布也是一个重要的研究方向。根据不同生物,其机体结构不同,石墨烯在其体内分布也会有所不同。氧化石墨烯(90 mg/kg,24 h)在体内主要分布在肝脏中,其后依次是肺、脾、肾、胃以及心脏[49]。不同的是,GO/ 葡聚糖复合物(20 mg/kg,24 h)在体内的最大浓度出现在脾脏中,其后依次是肝、肺、胃、皮肤、肾、心脏以及骨骼[48]。也有研究报道氧化石墨烯(13.8 mg/kg,30d)注入小鼠后主要分布在肺部、肝脏以及肾脏中。作为对照,大多数GO/ 葡聚糖却聚集在脾脏(20 mg/kg, 30d)[46]。以上研究结果表明,石墨烯的暴露时间和化学修饰才是影响其在生物体内分布的决定因素。
进入体内的石墨烯可以通过肠道、肾脏等组织脏器排出体外。众所周知,肾脏是人体内主要的排泄系统。然而,肾脏对石墨烯的廓清能力是有限的[46]。氧化石墨烯经由静脉注射,进入循环系统、胃部以及肠道,最终通过尿液和粪便排出体外[49]。在对小鼠的生物毒性实验中,小鼠经过一周的时间排出氧化石墨烯,并且未观察到明显的病理学反应[47]。与氧化石墨烯相似,聚乙二醇修饰的氧化石墨烯在60 天内被逐渐去除,经由尿液和粪便排出体外。也有学者做了关于氧化石墨烯在体内降解的研究。研究发现,除了器官的颜色变为棕色之外,聚集了氧化石墨烯的器官并没有功能性的损害,但是这些变色的器官在20 天后又恢复了原来的健康颜色[50]。此外,氧化石墨烯直接进入肺部后却可以引起肺炎和肉芽肿,这一症状的出现同氧化石墨烯的摄入浓度有密切关系,也充分说明不同的器官对石墨烯的生物学响应有所不同。
因此,研究体内各器官(脑组织、肺、肝、肾等)对石墨烯的廓清能力对理解石墨烯在体内的生命过程是十分重要的。石墨烯的尺寸和表面基团对于其在体内分布的影响还未形成定论。目前研究石墨烯在生物体内分布的主要方式是静脉注射,而口腔摄入、皮肤摄入以及呼吸摄入等方式还鲜有人尝试。不容忽视的是,石墨烯在大脑中发生聚集[47, 50],这势必会对人体健康存在重大风险,然而,人体中存在血脑屏障,即脑毛细血管壁与神经胶质细胞形成的血浆与脑细胞之间的屏障、由脉络丛形成的血浆和脑脊液之间的屏障等,这些屏障能够阻止某些物质由血液进入脑组织,但是是否能够有效阻止石墨烯的进入还需进一步研究。
总之,石墨烯在不同水平上与生物体存在具有不同特点的相关作用关系(表1)。了解石墨烯与生物体之间的相互作用关系有助于防范石墨烯所带来的环境健康风险,同时也可以发挥石墨烯的正面效应为人类健康做出贡献。
|
表1 石墨烯在不同水平上同生物体相互作用的特点 |
|
|
3 人体抵御石墨烯危害的方式及机制
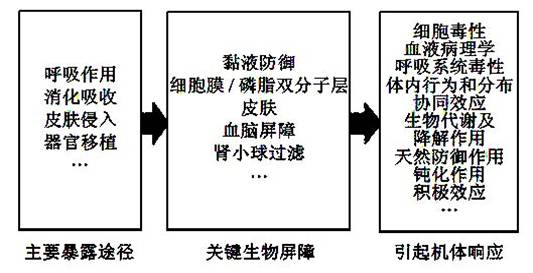
如前所述,石墨烯对人体存在潜在的健康风险。相应地,人体应对石墨烯的侵入存在一些天然的“生物屏障”(biobarriers),以降低石墨烯的不良影响。一般情况下,石墨烯进入人体的途径主要有4 种:呼吸摄入、饮食摄入、皮肤接触摄入以及注射或者器官移植等[51]。人体应对石墨烯干扰的的防御体系主要有黏液、细胞识别、磷脂双分子层、血脑屏障、皮肤、胎盘以及肾小球过滤等,这些均是体内抵御石墨烯等体外物质干扰的重要生物屏障(图5)。
|
|
|
图5 石墨烯影响人体健康的途径 |
3.1 黏液防御体系
黏液是一种从人体的黏膜层或黏膜下层分泌出来的液体,是一种典型的天然人体防御系统,内含有抗菌功能的酵素。黏液可以阻挡病原菌或者环境超细微颗粒进入眼睛、呼吸系统、胃肠道以及女性生殖道[52]。因此石墨烯作为一种干扰物质或许可以有效地被拦截,然而石墨烯与黏液的相互作用以及对分泌黏液的器官和组织的影响仍需进一步研究。
3.2 细胞防御
细胞识别是细胞同纳米颗粒相互作用同时对其进行“辨识”的过程,针对石墨烯而言,其本质是细胞(主要是细胞膜表面的蛋白质,糖类以及磷脂)同石墨烯之间发生相互作用。例如,不同类型的细胞在抵御环境中的纳米材料干扰时,细胞会表现出不同的ROS 水平,并且同细胞增殖有关的基因表达也会有所不同[53],表明纳米材料所表现出的毒性与吸收性随细胞类型的不同而有所差别[53-54]。因此,细胞识别过程或细胞同纳米材料的作用过程会影响纳米材料进入细胞,并且会影响其在细胞内的生命周期。不可否认,纳米材料的物理化学性质会影响其细胞毒性,但是,细胞与纳米材料的相互作用过程对于研究纳米材料对细胞的毒性才是更加重要的因素。之前文献报道过超顺磁氧化铁纳米颗粒同细胞作用时,其被细胞吸收的量和表现出的毒性同细胞类型有很大的关系[53-54]。但是,细胞膜表面蛋白质、糖类以及磷脂等重要组分识别石墨烯等纳米材料的相关机理还需要进一步研究。
此外,磷脂双分子层在细胞识别中也发挥了重要作用。磷脂双分子层是由两层磷脂分子组成的细胞薄膜,是细胞膜的重要组成,对维持细胞功能的正常运行具有重要意义。有报道指出,经过化学修饰的碳纳米管表面具有亲水性和疏水性交替分布的特征[55],这使得碳纳米管可以穿过磷脂双分子层。因此,由于氧化石墨烯的基团导致其具有两性,那么这就说明氧化石墨烯可以穿过细胞膜的双分子层。有学者研究过石墨烯和细胞膜的超结构,发现石墨烯可以存在于磷脂双分子层的疏水内侧[56]。考虑到石墨烯片层的边位较为尖锐,且具有良好的电传导能力以及膜的两性特性,因此在理论上石墨烯穿过磷脂双分子层是可以实现的。
3.3 血脑屏障
血脑屏障指在血管和脑之间有一种选择性地阻止某些物质由血进入脑的“屏障”。这种结构可使脑组织少受甚至不受循环血液中有害物质的损害,从而保持脑组织内环境的基本稳定,对维持中枢神经系统正常生理状态具有重要的生物学意义。血脑屏障的损坏会导致细胞死亡、神经系统性退变以及脑组织炎症等症状出现。有报道认为,石墨烯不能通过血脑屏障对大脑造成损坏[46]。但是其结论缺乏有效证据。也有研究发现,通过静脉注射在人体中导入石墨烯后,在大脑中发现了石墨烯的存在[47, 50],可能与血脑屏障损坏有关。然而,近期几乎没有关于石墨烯和血脑屏障相互作用的研究报道出现,这也将成为今后研究的一个重点。
3.4 皮肤抵御
石墨烯可以通过水溶液或者空气等介质与人体皮肤接触,进而对人体健康造成潜在隐患。然而,关于石墨烯在皮肤上沉积并且渗入的研究十分鲜见。迄今为止,大多数皮肤暴露试验均采用将纳米材料直接移植到皮下组织,检测其对组织细胞的毒性以及其他生物学响应[57],这恰好越过了皮肤这一天然屏障。有文献报道,暴露在Ag 和RGO 的复合物下的皮肤会发生水肿或者红斑等症状[58]。然而,石墨烯穿过皮肤的路径和机理还并不是很清楚,可能是通过表皮(毛孔)- 真皮层- 皮下脂肪组织- 动脉和静脉这一途径侵入人体的,不过这一假设仍需要大量的研究加以支撑。
3.5 胎盘防御
胎盘是母体与胎儿间进行物质交换的器官,是胚胎与母体组织的结合体。胎盘内进行物质交换的部位,主要在血管合体膜。血管合体膜是由合体滋养细胞、合体滋养细胞基底膜、绒毛间质、毛细血管基底膜和毛细血管内皮细胞5 层组成的薄膜。胎盘的功能很多,包括气体交换、营养物质供应、排除胎儿代谢产物、防御功能以及合成功能等。其中,胎盘的防御作用对胎儿的健康具有重要意义,然而,胎盘的防御作用极有限。各种病毒(如风疹病毒、巨细胞病毒等)、分子质量小对胎儿有害的药物,均可通过胎盘影响胎儿,致畸甚至死亡。细菌、弓形虫、衣原体、螺旋体可在胎盘部位形成病灶,破坏绒毛结构进入胎体感染胎儿。
目前,大量研究已经开始关注纳米材料可能会通过胎盘进入胎儿血液中,从而影响胎儿正常生长发育[59]。通常来说,纳米材料的尺寸决定了其在器官中的迁移和分布。已经有研究表明,100 nm 以下的硅和钛的氧化物纳米材料可以对胎盘和胎儿产生负面影响[59]。然而,石墨烯的尺寸一般在20~500 nm 之间,氧化石墨烯和还原型氧化石墨烯的尺寸相对较小。因此,石墨烯及其衍生物穿过胎盘是极有可能的。研究石墨烯通过胎盘的机制以及其潜在的危害也是未来重要的研究方向。
3.6 肾小球过滤
肾小球存在于肾脏中,其被鲍氏囊(Bowman's capsule)所包裹,是尿液形成的重要构造,被称为“血液净化器”。研究表明,进入人体的石墨烯虽然可以通过尿液排出,但其为肾小球所过滤的机制还未研究清楚[49]。肾小球过滤时滤孔尺寸一般在60 nm 以下[60],而实验所使用的石墨烯尺寸一般在20~500 nm,因此,一般情况下,石墨烯是不容易通过肾小球的。由于石墨烯在体内随血液循环的过程中会有不同程度的生物降解,所以可能是降解作用使得石墨烯的尺度减小,从而使一部分石墨烯通过肾小球过滤,另外,也有推测认为,肾小球中的孔洞在与石墨烯发生化学作用后变大,从而使石墨烯通过。总之,对肾小球过滤石墨烯的进一步研究,对深入理解人体清除石墨烯的机制有重要意义。
4 总结与展望
鉴于石墨烯纳米材料的独特性质和巨大潜力,其在能源、环境、生命等诸多领域的发展仍将坚定不移地持续下去。然而,正如前面所介绍的那样,纳米材料投放进入环境会对某些微生物群落造成负面影响[61-65]。由于石墨烯具有潜在的健康风险,那么降低其对环境中人和其他微生物的负面影响,以维持生态体系平衡的重大意义则不言而喻,并且这也会对未来设计具有生物安全性的石墨烯产品打下坚实的基础,为此,我们必将对未来石墨烯引发的健康风险问题持续关注。
石墨烯可以通过多种途径引发人体健康风险。石墨烯与人体细胞的相互作用十分复杂,其机理还需进一步研究。一方面,石墨烯可以促进细胞的增殖、同细胞很好地相容,对细胞产生积极的作用。例如,石墨烯可以加速人类间充质干细胞的成骨分化[66]。层黏蛋白包被的石墨烯可以促进人类神经干细胞分化为神经元细胞[67]。与石墨烯类似,氧化石墨烯也表现出了同人类细胞良好的生物相容性,可以促进同细胞的接触使细胞增殖[68]。然而,石墨烯同时也会破坏细胞,造成细胞死亡,例如,氧化石墨烯也可以导致细胞毒性,并且促使肺细胞溶解死亡[69]。以上情况说明石墨烯对不同的细胞作用存在显著差异。目前,促进人类细胞生长的机制已经被广泛研究,已得机理是石墨烯独特的电子结构可以刺激细胞生长和分化,另外,石墨烯促进相关基因的表达,并且利用电流刺激Ca 信号途径或者神经递质相关的蛋白质[68]。然而,石墨烯的细胞毒性及其机理还需要深入研究。
到目前为止,关于石墨烯的血液学研究基本上是空白。在这一方面主要存在4 个亟待解决的重要问题,首先是石墨烯在血液中的转移过程及其清除速率,其次是石墨烯同血蛋白,血小板以及血液补体级联的相互作用及其机制,再次是石墨烯对血红细胞的信号或离子通道的影响,最后是石墨烯的免疫毒性及其可能引发的相关疾病。
石墨烯对体内脏器的影响也是研究重点。由于肺部是人体的重要呼吸系统,石墨烯可以通过呼吸摄入到体内,那么它对肺部的影响是不可忽视的。然而,目前关于石墨烯对肺部影响的研究比较空缺,今后有几个亟待解决的问题:a、石墨烯和肺部表面活性蛋白的作用及其机制;b、石墨烯通过呼吸道时支气管上皮细胞的生物响应;c、石墨烯引起的肺部组织损坏和功能缺失及其具体的作用机制。
石墨烯在人体内的代谢也是未来重要的研究方向。纳米材料存在于血液中时,血浆蛋白会附着在纳米材料的表面,经过复杂的相互作用形成一种特殊结构的“蛋白质环”(protein corona)。蛋白质的附着会显著影响纳米材料在体内的分布和代谢。类似地,蛋白质的附着也会影响石墨烯在体内的代谢过程。一方面,血清白蛋白或者载脂蛋白的黏附作用会延长石墨烯在体内的停留时间[70]。另一方面,石墨烯会影响蛋白质的活性和结构。对于石墨烯在体内的转移研究而言,最重要的是定量确定不同浓度的石墨烯在不同的时间点,其尺寸、形态、聚集状态以及表面化学等性质的变化过程。对于石墨烯的药代动力学来说,在代谢过程中精确地定量石墨烯及其副产物仍是极大的挑战。另外,一些酶对石墨烯的催化降解作用也将引起关注,辣根过氧化物酶(horseradish POD)可以对氧化石墨烯进行有效的催化氧化[71]。然而,体内酶的种类繁多,这些酶对于石墨烯是否有催化降解作用还需要进一步探索。总而言之,科技是一把双刃剑,石墨烯也不例外。石墨烯及其复合材料在生物医药领域的广泛应用推动了医疗科技的发展,为人类的健康带来了福音。然而,石墨烯与人体接触而可能产生的健康风险同样不容忽视。关于石墨烯的健康风险研究任重道远,还需要不断地努力和技术的革新,才能最终使得石墨烯真正造福于人类。
参考文献
[1] Geim A K. Graphene: status and prospects. Science, 2009, 324(5934):1530-1534
[2] Feng L, Yang L, Huang Z, et al. Enhancing Electrocatalytic Oxygen Reduction on Nitrogen-Doped Graphene by Active Sites Implantation. Sci Rep, 2013, 3
[3] Feng L, Chen Y, Chen L. Easy-to-operate and low-temperature synthesis of gram-scale nitrogen-doped graphene and its application as cathode catalyst in microbial fuel cells. ACS Nano, 2011, 5(12):9611-9618
[4] Park S, Lee K S, Bozoklu G, et al. Graphene oxide papers modified by divalent ions—enhancing mechanical properties via chemical cross-linking. ACS Nano, 2008, 2(3): 572-578
[5] De M, Chou S S, Dravid V P. Graphene oxide as an enzyme inhibitor: modulation of activity of α-chymotrypsin. J Am Chem Soc, 2011, 133(44): 17524-17527
[6] Allen M J, Tung V C, Kaner R B. Honeycomb carbon: a review of graphene. Chem Rev, 2009, 110(1): 132-145
[7] Guo C X, Yang H B, Sheng Z M, et al. Layered graphene/quantum dots for photovoltaic devices. Angew Chem Int Ed, 2010, 49(17):3014-3017
[8] Liu Z, Robinson J T, Sun X, et al. PEGylated nanographene oxide for delivery of water-insoluble cancer drugs. J Am Chem Soc,2008, 130(33): 10876-10877
[9] 周国强, 陈春英, 李玉锋, 等. 纳米材料生物效应研究进展. 生物化学与生物物理进展, 2008, 35(9): 998-1006
[10] Akhavan O, Ghaderi E. Toxicity of graphene and graphene oxide nanowalls against bacteria. ACS nano, 2010, 4(10): 5731-5736.
[11] Liu S, Zeng T H, Hofmann M, et al. Antibacterial activity of graphite, graphite oxide, graphene oxide, and reduced grapheme oxide: membrane and oxidative stress. Acs Nano, 2011, 5 (9):6971-6980
[12] Tu Y, Lv M, Xiu P, et al. Destructive extraction of phospholipids from Escherichia coli membranes by graphene nanosheets. Nat Nanotechnol, 2013, 8(8): 594-601
[13] Liao K H, Lin Y S, Macosko C W, et al. Cytotoxicity of grapheme oxide and graphene in human erythrocytes and skin fibroblasts.ACS Appl Mater Inter, 2011, 3(7): 2607-2615
[14] Zhao X. Self-assembly of DNA segments on graphene and carbon nanotube arrays in aqueous solution: a molecular simulation study.J Phys Chem C, 2011, 115(14): 6181-6189
[15] Akca S, Foroughi A, Frochtzwajg D, et al. Competing interactions in DNA assembly on graphene. PLoS One, 2011, 6(4): e18442
[16] Spiwok V c, Hobza P, Rez仳c J. Free-energy simulations of hydrogen bonding versus stacking of nucleobases on a graphene surface.J Phys Chem C, 2011, 115(40): 19455-19462
[17] Wu M, Kempaiah R, Huang P J J, et al. Adsorption and desorption of DNA on graphene oxide studied by fluorescently labeled oligonucleotides. Langmuir, 2011, 27(6): 2731-2738
[18] Bonanni A, Pumera M. Graphene platform for hairpin-DNA-based impedimetric genosensing. ACS Nano, 2011, 5(3): 2356-2361
[19] Lei H, Mi L, Zhou X, et al. Adsorption of double-stranded DNA to graphene oxide preventing enzymatic digestion. Nanoscale, 2011,3(9): 3888-3892
[20] Ren H, Wang C, Zhang J, et al. DNA cleavage system of nanosized graphene oxide sheets and copper ions. ACS Nano, 2010, 4 (12):7169-7174
[21] Lu C H, Zhu C L, Li J, et al. Using graphene to protect DNA from cleavage during cellular delivery. Chem Commun, 2010, 46 (18):3116-3118
[22] Liu J, Fu S, Yuan B, et al. Toward a universal "adhesive nanosheet for the assembly of multiple nanoparticles based on a proteininduced reduction/decoration of graphene oxide. J Am Chem Soc,
2010, 132(21): 7279-7281
[23] Kim S N, Kuang Z, Slocik J M, et al. Preferential binding of peptides to graphene edges and planes. J Am Chem Soc, 2011,133(37): 14480-14483
[24] Ge C, Du J, Zhao L, et al. Binding of blood proteins to carbon nanotubes reduces cytotoxicity. Proc Natl Acad Sci USA, 2011,108(41): 16968-16973
[25] Shan C, Yang H, Han D, et al. Water-soluble graphene covalently functionalized by biocompatible poly-L-lysine. Langmuir, 2009,25(20): 12030-12033
[26] Alwarappan S, Liu C, Kumar A, et al. Enzyme-doped grapheme nanosheets for enhanced glucose biosensing. J Phys Chem C, 2010,114(30): 12920-12924
[27] Zhang J, Zhang F, Yang H, et al. Graphene oxide as a matrix for enzyme immobilization. Langmuir, 2010, 26(9): 6083-6085
[28] Liu X, Sen S, Liu J, et al. Antioxidant deactivation on graphenic nanocarbon surfaces. Small, 2011, 7(19): 2775-2785
[29] Geim A K, Novoselov K S. The rise of graphene. Nat Mater, 2007,6(3): 183-191
[30] Song Y, Qu K, Zhao C, et al. Graphene oxide: intrinsic peroxidase catalytic activity and its application to glucose detection. Adv Mater, 2010, 22(19): 2206-2210
[31] Song Y, Chen Y, Feng L, et al. Selective and quantitative cancer cell detection using target-directed functionalized graphene and its synergetic peroxidase-like activity. Chem Commun, 2011, 47(15):
4436-4438
[32] Barnard A S, Snook I K. Size-and shape-dependence of the graphene to graphane transformation in the absence of hydrogen.J Mater Chem, 2010, 20(46): 10459-10464
[33] Bagri A, Mattevi C, Acik M, et al. Structural evolution during the reduction of chemically derived graphene oxide. Nat Chem, 2010,2(7): 581-587
[34] Wang Y, Lu J, Tang L, et al. Graphene oxide amplified electrogenerated chemiluminescence of quantum dots and its selective sensing for glutathione from thiol-containing compounds.Anal Chem, 2009, 81(23): 9710-9715.
[35] Lim B, Xia Y. Metal nanocrystals with highly branched morphologies. Angew Chem Int Ed, 2011, 50(1): 76-85
[36] Markovic Z M, Harhaji-Trajkovic L M, Todorovic-Markovic B M,et al. In vitro comparison of the photothermal anticancer activity of graphene nanoparticles and carbon nanotubes. Biomaterials, 2011,
32(4): 1121-1129
[37] Fan Z, Yan J, Zhi L, et al. A three-dimensional carbon nanotube/graphene sandwich and its application as electrode in supercapacitors. Adv Mater, 2010, 22(33): 3723-3728
[38] Park S, Mohanty N, Suk J W, et al. Biocompatible, robust freestanding paper composed of a TWEEN/graphene composite. Adv Mater, 2010, 22(15): 1736-1740
[39] Chen G Y, Pang D P, Hwang S M, et al. A graphene-based platform for induced pluripotent stem cells culture and differentiation.Biomaterials, 2012, 33(2): 418-427
[40] Chen W, Yi P, Zhang Y, et al. Composites of aminodextran-coated Fe3O4 nanoparticles and graphene oxide for cellular magnetic resonance imaging. ACS Appl Mater Inter, 2011, 3(10): 4085-4091
[41] Kim S, Ku S H, Lim S Y, et al. Graphene-biomineral hybrid materials. Adv Mater, 2011, 23(17): 2009-2014
[42] Chang Y, Yang S T, Liu J H, et al. In vitro toxicity evaluation of graphene oxide on A549 cells. Toxicol Lett, 2011, 200 (3): 201-210
[43] Liu K, Zhang J J, Cheng F F, et al. Green and facile synthesis of highly biocompatible graphene nanosheets and its application for cellular imaging and drug delivery. J Mater Chem, 2011, 21 (32):12034-12040
[44] Li Y, Liu Y, Fu Y, et al. The triggering of apoptosis in macrophages by pristine graphene through the MAPK and TGF-beta signaling pathways. Biomaterials, 2012, 33(2): 402-411
[45] Karmali P P, Simberg D. Interactions of nanoparticles with plasma proteins: implication on clearance and toxicity of drug delivery systems. Expert Opin Drug Delivery, 2011, 8(3): 343-357
[46] Wang Y, Xiu F, Wang Y, et al. Coherent magnetic semiconductor nanodot arrays. Nanoscale Res Lett, 2011, 6(1): 134-141
[47] Zhang X, Yin J, Peng C, et al. Distribution and biocompatibility studies of graphene oxide in mice after intravenous administration.Carbon, 2011, 49(3): 986-995.
[48] Zhang S, Yang K, Feng L, et al. In vitro and in vivo behaviors of dextran functionalized graphene. Carbon, 2011, 49(12): 4040-4049
[49] Zhan L, Yanxia G, Xiaoyong Z, et al. Biodistribution of co-exposure to multi-walled carbon nanotubes and graphene oxide nanoplatelets radiotracers. J Nanopart Res, 2011, 13(7): 2939-2947
[50] Yang K, Wan J, Zhang S, et al. In vivo pharmacokinetics, long-term biodistribution, and toxicology of PEGylated graphene in mice.ACS Nano, 2010, 5(1): 516-522
[51] Sanchez V C, Jachak A, Hurt R H, et al. Biological interactions of graphene-family nanomaterials: an interdisciplinary review. Chem Res Toxicol, 2011, 25(1): 15-34
[52] Wang Y Y, Lai S K, So C, et al. Mucoadhesive nanoparticles may disrupt the protective human mucus barrier by altering its microstructure. PLoS One, 2011, 6(6): e21547
[53] Mahmoudi M, Laurent S, Shokrgozar M A, et al. Toxicity evaluations of superparamagnetic iron oxide nanoparticles: cell "vision" versus physicochemical properties of nanoparticles. ACS nano, 2011, 5(9): 7263-7276
[54] Koenig S P, Boddeti N G, Dunn M L, et al. Ultrastrong adhesion of graphene membranes. Nat Nanotechnol, 2011, 6(9): 543-546
[55] Pogodin S, Slater N K, Baulin V A. Surface patterning of carbon nanotubes can enhance their penetration through a phospholipid bilayer. ACS nano, 2011, 5(2): 1141-1146
[56] Titov A V, Král P, Pearson R. Sandwiched Graphene Membrane Superstructures. ACS Nano, 2009, 4(1): 229-234
[57] Johnston H J, Hutchison G R, Christensen F M, et al. A critical review of the biological mechanisms underlying the in vivo and in vitro toxicity of carbon nanotubes: the contribution of physicochemical characteristics. Nanotoxicology, 2010, 4(2): 207-246
[58] Xu W P, Zhang L C, Li J P, et al. Facile synthesis of silver@graphene oxide nanocomposites and their enhanced antibacterial properties. J Mater Chem, 2011, 21(12): 4593-4597
[59] Keelan J A. Nanotoxicology: nanoparticles versus the placenta. Nat Nanotechnol, 2011, 6(5): 263-264
[60] Kostarelos K. Carbon nanotubes: Fibrillar pharmacology. Nat Mater, 2010, 9(10): 793-795
[61] Chen Y, Wang D, Zhu X, et al. Long-term effects of copper nanoparticles on wastewater biological nutrient removal and N2O generation in the activated sludge process. Environ Sci Technol,2012, 46(22): 12452-12458
[62] Mu H, Chen Y, Xiao N. Effects of metal oxide nanoparticles (TiO2,Al2O3, SiO2and ZnO) on waste activated sludge anaerobic digestion.Bioresour Technol, 2011, 102(22): 10305-10311
[63] Zhao Y, Chen Y. Nano-TiO2 enhanced photofermentative hydrogen produced from the dark fermentation liquid of waste activated sludge. Environ Sci Technol, 2011, 45(19): 8589-8595
[64] Zheng X, Chen Y, Wu R. Long-term effects of titanium dioxide nanoparticles on nitrogen and phosphorus removal from wastewater and bacterial community shift in activated sludge. Environ Sci Technol, 2011, 45(17): 7284-7290
[65] Zheng X, Wu R, Chen Y. Effects of ZnO nanoparticles on wastewater biological nitrogen and phosphorus removal. Environ Sci Technol, 2011, 45(7): 2826-2832
[66] Nayak T R, Andersen H, Makam V S, et al. Graphene for controlled and accelerated osteogenic differentiation of human mesenchymal stem cells. ACS Nano, 2011, 5(6): 4670-4678
[67] Park S Y, Park J, Sim S H, et al. Enhanced differentiation of human neural stem cells into neurons on graphene. Adv Mater, 2011,23(36): H263-H267
[68] Liu Y, Yu D, Zeng C, et al. Biocompatible graphene oxide-based glucose biosensors. Langmuir, 2010, 26(9): 6158-6160
[69] Vallabani N, Mittal S, Shukla R K, et al. Toxicity of graphene in normal human lung cells (BEAS-2B). J Biomed Nanotechnol,2011, 7(1): 106-107
[70] Ishida T, Harashima H, Kiwada H. Interactions of liposomes with cells in vitro and in vivo: opsonins and receptors. Curr Drug Metab,2001, 2(4): 397-409
[71] Kotchey G P, Allen B L, Vedala H, et al. The enzymatic oxidation of graphene oxide. ACS nano, 2011, 5(3): 2098-2108