驱蚊纳米胶囊制备初探yd19217
王俊华,黄钢,董凤春,贾永堂 五邑大学纺织服装学院,广东江门529020
收稿日期:2014-10-1l
基金项目:广东高校优秀青年创新人才培养计划(2013LYM-0092)
作者简介:王俊华(1975-),女,安徽安庆人,讲师,博士,主要研究领域为功能纺织品及新型印染加工技术
原载:印染助剂2015/12;7-10
【摘要】以避蚊胺为芯材,三聚氰胺甲醛树脂为壁材,采用原位聚合法制备驱蚊纳米胶囊.对影响胶囊制备的诸多因素如乳化剂种类、乳化剂用量、油水比、反应时间、乳化速率等进行了考察 吉果表明,当选用苯乙烯一马来酸酐共聚物(SMA)为乳化剂、用量为5%,油水比为10:5O,乳化速率15 000 r/min以上,反应时间为2.5~3.0 h时,可以制备纳米胶囊,其平均粒径约为100 nm,且胶囊稳定存在于乳液体系中.
【关键词】 避蚊胺;驱蚊纳米胶囊;三聚氰胺甲醛树脂
【中图分类号】TQ610.4 文献标识码:A 文章编号:1004-0439(2015)12-0007-04
蚊子被称为昆虫界的四害之一,据世界卫生组织统计,全球每年大约有几亿人因蚊子而生病[1].传统的驱蚊方法多是喷洒杀虫剂,但药剂效用时间短,耗用量大,既不环保,也不经济.曾有学者利用微胶囊技术制备驱蚊的苄氯菊酯微胶囊[2],以提高驱蚊的效用性。而直径通常在1 µm以下的纳米胶囊,其缓释性和靶向性均优于微胶囊,故近年来纳米胶囊的应用领域在不断拓宽[3-4]。
避蚊胺是一种性能优异,使用最为广泛的蚊虫驱避剂.本文以避蚊胺为芯材,三聚氰胺甲醛树脂为壁材,采用原位聚合法制备驱蚊纳米胶囊.对影响胶囊制备的诸多因素如乳化剂种类、乳化剂用量、油水比、反应时间、乳化速率等进行了考察,以期获得制备纳米胶囊的较佳工艺条件。
1 试验
1.1 药品
N,N-二乙基-3-甲基苯甲酰胺(DEET,99.9%,上海宁都商贸有限公司),三乙醇胺、苯乙烯-马来酸酐共聚物(SMA)、无水柠檬酸、三聚氰胺(TMM)、甲醛(37%)、氨水(江门市铜锋试剂有限公司)。
1.2 仪器
NANOPLUS型激光纳米粒度测定仪(麦克默瑞提克上海仪器有限公司),FJ300-S数显高速分散均质机(深圳市瑞鑫达仪器有限公司),CX31光学显微镜(德慧光学电子有限公司),JJ-1电动搅拌器,LSP恒温磁力搅拌器,HHL-6恒温水浴锅,电子天平。
1.3 胶囊制备原理
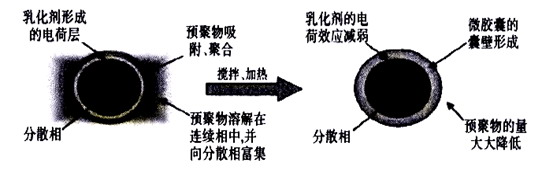
在原位聚合法制备胶囊的工艺中,分散相和连续相在乳化剂的作用下混合形成乳化液.胶囊囊壁的单体成分及催化剂全部位于分散相液滴的内部或外部.在胶囊化体系中,单体可溶于某一种单一相,但单体形成的聚合物在整个体系中则是不可溶的.单体聚合反应生成了分子质量相对较低的预聚物,在预聚物尺寸逐步增大并沉积在分散相液滴表面的过程中,由于预聚物间交联或聚合反应的不断进行,最终形成了覆盖分散相液滴全部表面的固体胶囊外壳。
高分子乳化剂SMA带有羧酸根负离子,会在芯材油相液滴表面形成一个较强的负电场,吸引周围带正电荷的预聚物树脂,使之“富集”在避蚊胺液滴表面.随着正电荷低聚体的“富集”,最终胶体粒子形成电中性的球状粒子,而低聚体在“液滴”表面沉淀下来后开始交联形成网状的“外壳”,最后将避蚊胺油滴完全“包裹”起来,成为避蚊胺胶囊[7],胶囊制备原理如下:
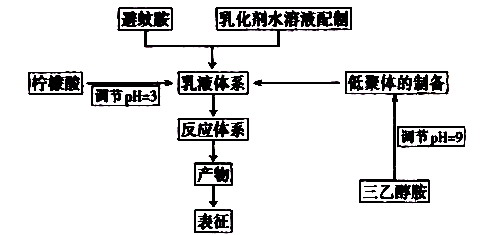
1.4 胶囊制备
1.4.1 乳化剂水溶液的制备
称取所需量SMA,使之完全溶于滴加少量氨水的水溶液中。
1.4.2 避蚊胺乳液体系的制备
将lO mL避蚊胺加入到50 mL SMA水溶液中,用均质机以12 000 r/min乳化1 h,用10%的柠檬酸调节体系的pH至3。
1.4.3 囊壁低聚体的制备
将24 g(37%)甲醛和15 g TMM混合,用三乙醇胺调节溶液pH至9,于70℃下不断搅拌制备水溶性的透明囊壁低聚体。
1.4.4 避蚊胺胶囊的制备
将避蚊胺乳液转移到250 mL的三口瓶中,控温70℃,再将囊壁低聚体滴入其中(为避免低聚体变浑浊,滴加的时间不宜过长),以200 r/min搅拌反应2
h,得避蚊胺胶囊体系。
胶囊制备具体流程如下:
1.5 表征
胶囊形态由XSP-BM显微镜和Panasonic摄像头摄像并用数字图像分析系统分析.胶囊平均粒径及粒径分布曲线由JL-1155型激光纳米粒度测定仪测定。
2 结果与讨论
2.1 乳化剂种类
乳化剂在胶囊的制备过程中非常重要,不仅使油水相形成稳定的乳状液,还能防止分散相絮凝、聚结,只有选择适宜的乳化剂,才能制备出形态良好、粒径均一的胶囊。
分别选用SDS、平平加O、SMA为乳化剂制备驱蚊纳米胶囊.试验中发现以SDS、平平加0为乳化剂时,出现明显分层,而以SMA为乳化剂制备的胶囊体系呈稳定的乳状液。
胶囊外壳是由低聚体在液滴表面沉积并交联而形成.本文低聚体带正电荷,如果吸附在避蚊胺油滴外围的乳化剂带负电荷,则会将低聚体吸引并富集于油滴表面,使成囊反应易于发生.故乳化剂带负电荷对本试验的成败具有决定性的作用。非离子型表面活性剂平平加O本身是一种性能优良的乳化剂,但并不适用.SDS是阴离子型表面活性剂,但制备胶囊的效果也不好,其可能原因是SDS的起泡能力强于SMA,在高速分散均质机及搅拌机作用下.乳化液易起泡,导致三聚氰胺-甲醛树脂初缩体在滴加过程中在泡沫表面发生聚集形成沉积物,影响正常的成囊反应;另外,在酸性条件下,SDS电离度降低,乳化制得的O/W型乳液稳定性较差,在胶囊制备过程中出现了分层现象.故在后续试验中,均采用SMA作为乳化剂。
2.2 乳化剂用量
由图l可知,当乳化剂用量大于5%时,胶囊粒径不均一,有的粒径较大.随着乳化剂用量的进一步增大,胶囊出现团聚现象,大量的胶囊粒子聚集在一起;用量为5%时,胶囊粒子大小、形态较均一,故乳化剂用量选择5%为宜。
|
|
|
油水比10:50,乳化速率12000 r/min。反应时间2
h。 图l不同乳化剂用量下制备的胶囊形态 |
2.3 油水比
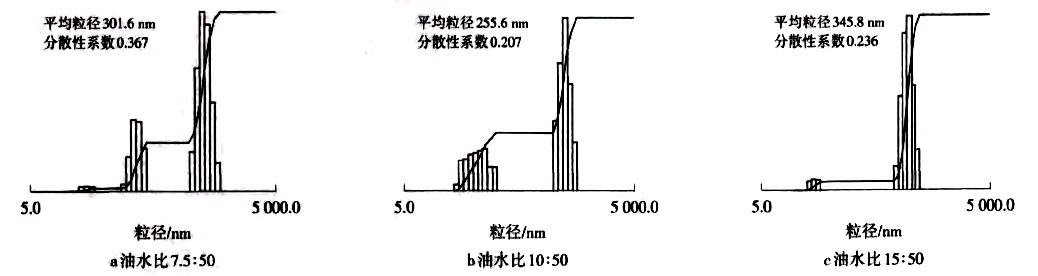
油水比是指油相避蚊胺溶液体积与SMA水相溶液体积之比.改变油水比,分别以5:50、7.5:50、10:50、15:50、20:50来制备胶囊,图2、图3即制得胶囊的形态图及粒径分布图.试验中发现。油水比低至5:50或高至20:50时,制备胶囊均失败.由图2c可知,油水比为15:50时,胶囊数目较少,容器中及容器内壁还残存较多油滴;另从图3c可以看出,胶囊粒径较大,且分散性系数(表示粒径的均匀性,此值以小为好)也较大.由图2a可以看出,油水比为7.5:50时.胶囊数目较多,形态也较规整,但粒径较大;另从图3a可知,平均粒径为301.6 nm,粒径分散性系数也较大,达0.367.由图2b、3b可知,当油水比为10:50时,胶囊粒径较为均一,平均粒径为255.6 nm,分散性系数为0.207,故油水比10:50为较佳比例。
|
|
|
图2 不同油水比下制备的胶囊形状 |
|
|
|
乳化剂5%,乳化速率12 000 r/min.反应时间2
h 图3不同油水比下制备的胶囊粒径分布 |
2.4 反应时间
由图4可知,当反应时间为3.5和4.0 h时制得的胶囊粒子直径在200
nm左右,分散性系数也较小,但胶囊粒子在乳液中发生了“团聚”,形成了较大的“团聚体”。其粒径大小超过仪器所测试范围,故此时平均粒径的测试结果不包括“团聚体”,实际上只是分散在水相中较小胶囊的平均粒径,故所测数据有较大误差.当反应时间为2.0 h时,胶囊的平均粒径为240.6nm,但胶囊的分散性系数高达0.389,生成的胶囊数目相对较少.当反应时间为2.5或3.0 h时,胶囊的平均粒径约为200 nm,且分散性系数较小、粒径较均一.故选择反应时问2.5-3.0 h较为合适。
|
|
|
乳化剂5%,油水比10:50.乳化速率12 000 r/min 图4不同反应时间下制备的胶囊彤状及平均粒径 |
2.5 乳化速率
由图5可知,乳化速率为9 000 r/min时,制备的胶囊平均粒径为354.7 nm.分散性系数为0.398,胶囊粒径与分散性系数均较大.随着乳化速率的提高,胶囊平均粒径越来越小.15 000 r/min时,胶囊粒径为103.5nm,继续提高乳化速率至18 000 r/min时.胶囊粒径小于100 nm,达到真正的纳米级。
|
|
|
乳化制5%,油水比10:50.反应时间2.5 h 图5 不同乳化速率下制备的胶囊形状及平均粒径 |
3 结论
(1)以避蚊胺为芯材、三聚氰胺甲醛树脂为壁材、SMA为乳化剂,采用原位聚合法来制备纳米级避蚊胶囊的方法是可行的。
(2)乳化剂SMA用量5%,油水比10:50,乳化速率15
000r/min以上,反应时间2.5-3.0 h时,可以制备纳米胶囊.其平均粒径约为100 nm,且胶囊稳定存在于乳液体系中。
参考文献:
[1]辛飞跃,尹斌开,范国荣,等.蚊虫驱避剂及其剂型的研究[J].江西林业科技,2008(4);10-13
[2]吴英,冯卫,缓释性驱蚊檄胶囊的研制[J],上海工程技术大学学报,1995,9(4);72-74
[3]OPPENHEIM
R C,STEWART N F,The
production and evaIuation of orally administered in sulin nanoparticles[J],Drug Dev,and
Pharm,1982(8);531-536
[4]
FLORENCE A T,The oral absorption of micro-and,nanoparticulates;Neither exceptional nol unusual[J],Pharm,Res,1997,14;259-266
[5]RUXANDRA
G,DENIS L,Relationship between complement activation
cellular uptake and surface physicochemical aspects of novel PEG midified nanocapsules[J],Biomaterials,2001,22;2
967-2 979
[6]CALVO P,VILA J,Effect of lysozyme on the
stability of polyester nanocapsules and nanoparticles;stabilization approaches[J],Biomaterial
1997,18(19);1305-1310
[7] 刘志明,植物叶片仿生伪装材料研究[D],国防科技大学博士学位论文2009,98-101