纳米ZnO的超声辅助合成及其光催化性能研究yd16727
彭勇刚1,2,纪俊玲2,张云龙2,万怀新3,陈大俊1 1、东华大学材料科学与工程学院,纤维材料改性国家重点实验室,上海201620;2、常州大学石油化工学院,江苏常州213164;3、江苏麦阁吸附剂有限公司, 江苏盱眙211700
收稿日期:2012-12-26
基金项目:江苏省中小企业创新资金(BC2011162);常州大学校扶持基金(ZMF10020059);常州市科技支撑计划(工业)(CE20110043)
作者简介:彭勇刚(1979-),男,湖北天门人,在读博士,主要从事新型光催化材料的开发.
通信作者:陈大俊,E-mail:edj@dhu.edu.cn.
原载:印染助剂,2013/10;12-15
【摘要】 采用超声辅助非水解溶胶-凝胶技术制备纳米ZnO,探讨了醇种类对产物结构、形貌的影响,并对反应机理进行了推测.以亚甲基蓝为模拟污染物,对纳米ZnO的光催化性能进行了评价.结果表明,当ZnO用量为0.6 g/L,染液初始质量浓度为20mg/L,紫外光照射120 min后,亚甲基蓝几乎完全降解。
【关键词】超声;ZnO;光降解;非水解溶胶一凝胶技术
【中图分类号】TQ132.4+ 1;TQ034;TQ028.3 8 文献标识码:A 文章编号:1004-0439(2013)10-0012-04
ZnO是一种重要的宽禁带Ⅱ~Ⅵ簇半导体氧化物,禁带宽度约为3.2 eV,具有纤锌矿结构,属于六方晶系[1].纳米ZnO由于具有表面效应、量子尺寸效应、体积效应等特点,具有普通ZnO无法比拟的特殊物理化学性能.在紫外光照射下,纳米ZnO表面价带中的电子获得光子的能量跃迁至导带,形成光生电子,在价带中相应形成空穴.光生电子会与溶液中溶解的氧分子反应,形成超氧离子自由基(·02-)和过氧化氢自由基(·OOH);光生空穴与吸附在ZnO表面的H20发生作用,形成具有强氧化性的羟基自由基(·OH);·OOH、
·02-、·OH可将吸附在ZnO表面的各种有机污染物氧化分解为CO2、H20等无机小分子[2].近年来,有关纳米ZnO在光催化方面的应用研究越来越多.
纳米ZnO的制备主要有:直接沉淀法[3]、溶胶-凝胶法[4]、水热合成法[5]等.这些方法要么需要高温煅烧后处理,要么反应时间长、对设备要求高.近年来,超声技术因操作简单、易于控制、效率高等优点,被广泛用于辅助纳米材料的制备[6].超声辅助纳米材料制备的作用机理源于声空化效应.声空化效应是指液体中微小气泡的形成、生长、崩溃及其引起的物理、化学变化[7].声空化产生的气泡崩溃可以释放出巨大的能量,产生速度高达110 m/s的微射流,可以产生瞬间的高温(5 000 K甚至10 000 K以上)高压(100 MPa以上)以及超过10 K/s的加热和冷却速度.这种极端条件可以提高化学反应速率,促进固体新相的生成和纳米粒子晶型的转化[8]。
本文采用超声辅助非水解溶胶-凝胶技术制备纳米ZnO,探讨了溶剂种类对产物形貌、性能的影响,同时,以亚甲基蓝作为模拟污染物,考察了纳米ZnO的光催化性能。
1 试验
1.1 材料
亚甲基蓝、乙酸锌、一缩二乙二醇、1,2-丙二醇、1,3-丙二醇、1,4-丁二醇、正丙醇、乙二醇(化学纯,上海凌峰化学试剂有限公司).
1.2 仪器
722S分光光度计(上海精密科学仪器公司),高速离心机(上海安亭科学仪器厂),XO-SM400超声微波反应器(南京先欧仪器制造有限公司)。
1.3 纳米ZnO的制备
将1.756 g(8 mmo1)Zn(OAc)2·6H20(M=219.5 g/mo1)加入到40 mL醇溶液中,在搅拌条件下油浴加热至120℃,待Zn(OAc)·6H2O完全溶解后,降至室温;将钛合金超声探头f直径15 mm)插入溶液中央,探头端部位于液面下1 cm,在一定功率下,超声辐射2 h后,将反应液取出,自然冷却至室温后,高速离心,将得到的固体产物分别用无水乙醇、去离子水洗涤多次后,80℃真空干燥.
1.4 测试
XRD:采用日本理学Dimax 2500 PC型X射线衍射仪进行测试,铜靶(λ=0.154 nm),工作电压40 kV,工作电流30 mA,扫描范围10°~70°,扫描速率4°/min。
TEM:采用JEOL JEM-2100透射电子显微镜观察产物形貌,最大加速电压300 kV。
降解率:取一定量的光催化剂加入到亚甲基蓝溶液中,磁力搅拌下暗处吸附1 h,以达到吸附-解吸平衡;然后,将亚甲基蓝溶液倒入自制的圆柱形光催化玻璃反应器(高50 mm,直径60 mm)中进行光催化试验,以一根l5 w紫外灯作为光源,最大吸收波长为365 nm,光源与染液液面之间的垂直距离为10 cm.反应一定时间后,取样、离心分离,测量上层清液的吸光度,按下式计算:降解率=(1-ct/c0)x100%.式中:c0为光催化反应前模拟废水的染料浓度;ct为光照t时间后,模拟废水的染料浓度。
2 结果与讨论
2.1 不同醇溶剂对ZnO结构、形貌的影响
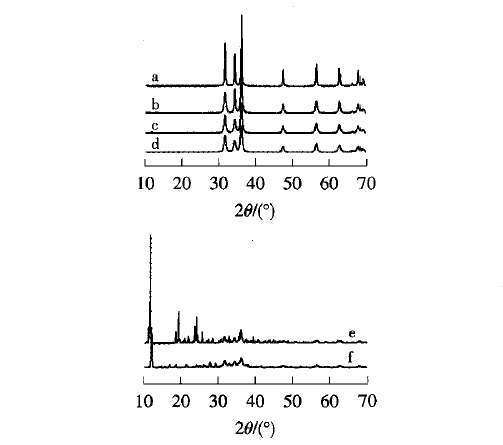
从图1a、1b、lc、1d可知,以一缩二乙二醇、1,4-丁二醇、l,3一丙二醇、1,2一丙二醇作为溶剂时,所有样品的衍射峰显示样品均为六方纤锌矿结构(JCPDS卡片号:36-1451),没有出现其他杂质的衍射峰,表明所得样品均为纯的ZnO.衍射角20=31.7°,34-3°,36.2°,47.5°,56.5°,62.8°,68.0°分别对应纤锌矿结构ZnO的(100)(002)(101)(102)(110)(103)(112)晶面衍射.所有样品的衍射峰都较强且尖锐,表明所得ZnO具有良好的结晶性.相比之下,以一缩二乙二醇为溶剂所得样品的衍射峰强度最大,峰形更尖锐,表明其具有更好的结晶度.原因是一缩二乙二醇具有最高的沸点(245℃)[9]。.
从图1e、1f可以看出,以乙二醇、正丙醇为溶剂所得样品均不是纯的ZnO.这可能是由于正丙醇的沸点较低(97.19℃);尽管乙二醇的沸点较高,但在催化剂ZnO的作用下,乙二醇会发生分子内和分子间的脱水,抑制ZnO的生成.
|
|
|
a- 缩二乙二醇;b-1,4-丁二醇;c-1,3-丙二醇;d-1,2-丙二醇; e-乙二醇;f-正丙醇 超声反应2 h |
|
图1 不同醇溶剂所得样品的XRD图谱 |
从图2可知,以一缩二乙二醇为溶剂,得到了分散性好、尺寸均匀的ZnO纳米棒和纳米颗粒;以1,4-丁二醇、1,3-丙二醇为溶剂,制得的ZnO也是颗粒状和棒状结构,但分散性较差;以1,2-丙二醇为溶剂,所得ZnO为颗粒状结构,分散性更差,粒子团聚严重.可能原因是4种醇的沸点、结构、极性不同。
|
|
|
a-缩二乙二醇:b-1,4-丁二醇;c-1,3-丙二醇;d-l,2-丙二醇 |
|
图2不同醇溶剂所得ZnO的TEM图 |
2.2反应机理
根据以上试验结果,推测ZnO粒子的形成过程可能如下:
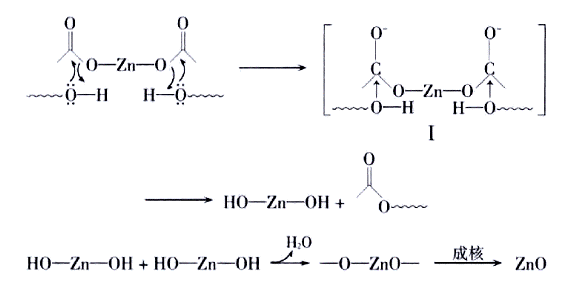
在醋酸锌分子中,Zn2+离子可看作是一种路易斯酸,它使得羰基碳原子上电子云密度降低,醇羟基上的氧首先对醋酸锌分子中的羰基碳原子进行亲核进攻,形成中间产物I;在超声波作用下,发生酯消除反应生成Zn(OH)2,进一步脱水,成核形成ZnO.在超声辐射下,声空化效应会在溶液中产生瞬间的高温高压,满足了热力学结晶体系的能量要求,促进Zn(OH)2的脱水、ZnO晶核的生成.一般情况下,在超声辐射下,所有取向的生长速率同时增加,但对ZnO而言,由于各向异性生长习性,沿c轴方向生长所需能量更小,导致晶体沿该轴方向生长更快,易形成棒状ZnO[10].
2.3 光催化性能
以一缩二乙二醇为溶剂制备纳米ZnO,以亚甲基蓝为模拟污染物,对制备ZnO的光催化性能进行评价.
2.3.1 光照时间
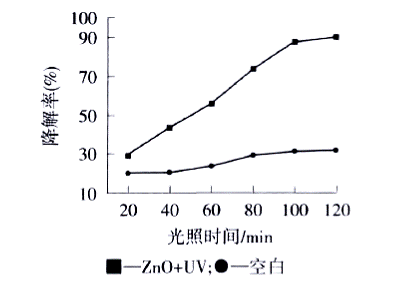
取同样体积的染料溶液在不加ZnO的条件下。直接用紫外光照射,作为空白.从图3可以看出,亚甲基蓝降解率随着时间延长逐渐增大;经紫外光照射120min后,其降解率达到90.2%.然而,在没有ZnO存在的情况下,亚甲基蓝降解率仅为31.8%.这表明紫外光和ZnO是亚甲基蓝降解的必要条件.
|
|
|
50 mL20 mg/L的亚甲基蓝溶液.50 mg纳米ZnO |
|
图3光照时间对亚甲基蓝降解率的影响 |
2.3.2 ZnO用量
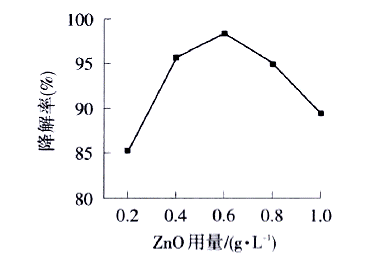
从图4可以看出,随着催化剂ZnO用量的增加,亚甲基蓝的降解率逐渐增大,当达到0.6g/L时,继续增加ZnO用量,溶液的降解率反而降低.原因是随着ZnO用量的增加,与亚甲基蓝溶液接触的活性位数量增加,有利于亚甲基蓝的光降解;同时,ZnO用量增加会使得溶液的浑浊度增加,阻碍紫外光的透射.因此,ZnO最佳用量为0.6 g/L.
|
|
|
50mL 20mg/L的亚甲基蓝溶液,紫外光照射120mtn |
|
图4
ZnO用量对亚甲基蓝降解率的影响 |
2.3.3 染液初始质量浓度
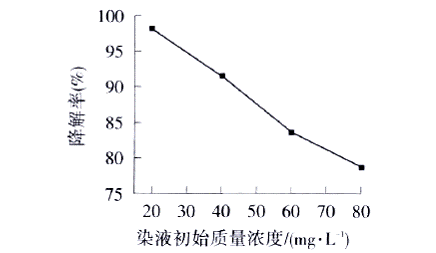
从图5可以看出,随着染液初始质量浓度的增加,亚甲基蓝溶液的降解率逐渐降低.由于染料溶液质量浓度增加,溶液颜色加深,使得透过溶液到达ZnO表面的紫外光减少,导致产生的光生电子-空穴对减少.
|
|
|
50 mL亚甲基蓝溶液,30 mg纳米Zn0,紫外光照射120 min |
|
图5 染液初始质量浓度对亚甲基蓝降解率的影响 |
3 结论
(1)采用超声辅助非水解溶胶-凝胶技术制备纳米Zn0,以一缩二乙二醇为溶剂,并对反应机理进行了推测.
(2)随着ZnO用量的增加,亚甲基蓝的降解率先增大后减小.当ZnO用量为0.6 g/L时,降解率最高;随着催化时间的延长,降解率逐渐增加,当紫外光照射120min后.亚甲基蓝的降解率达到90.2%;染液初始质量浓度增加使得溶液颜色增加,从而导致染料降解率的下降.
参考文献:
[1] XU
Sheng,WANG Zhong-lin.One-dimensional ZnO nanostructures:solution
growth and functional properties[J].Nano Res.,2011,4(11):1013-1098
[2]GUO
Mu-yao.NG A M C.LIU Fang-zhou.et a1.Photocatalytic activity of metal oxides-the
role of holes and OH·radicals[J]Appl.Catal B:Environ,201l,107:150-157.
[3]昌红金.江萍,刘宇珊,等.不同形貌纳米Zn0的合成及其光催化性能研究[J]功能材料,2010,41(2):292-295.
[4]HE
Rong-liang,HOCKlNG R K,TSUZUKI T. Local structure and pho toeatalytic property of sol-gel
synthesized ZnO doped with transition metal oxides[J].J.Mater Sci.2012,47:3150-3158.
[5] KANSAL
S K,ALl A H,KAPOOR S,et al. Synthesis of flower like zinc oxide nanostructure
and its application as a photocatalyst[Jl Sep Purif.Techno1.,2011.80:125-130
[6]程新峰,付云芝,涨小娇.超声法制备纳米材料的研究进展[J]无机盐工业,2011,42(11);1-5
[7]何寿杰,哈静,王云明,等超声化学在纳米材料制备中的应用[J]化学通报.2008,71(11):846-851.
[8]邓崇海,胡寒梅,黄显怀.超声化学合成多角星形氧化锌[J]无机化学学报,2009,25(3):469-473.
[9]DAKHLAOUI
A,JENDOUBI M,SMIRI L S,et al.Synthesis,characterization and optical properties
of ZnO nanopartieles with controlled size and
morphology[J]J.Crys.Growth,2009,311:3989-3996
[10l沈国柱,徐政.朱英杰.不同形貌Zn0纳米粒子的超声化学法制备与表征[J]无机化学学报,2005,21(6):893-896.