全互穿半乳糖基水凝胶的制备与细胞活性研究yd15522
郭袈1,2,张青松1,2,何涛1,2 1.天津工业大学,材料科学与工程学院,天津300387;2.天津工业大学中空纤维膜材料与膜过程省部共建国家重点实验室培育基地,天津300387
收稿日期:2012-06-05
基金项目:国家自然科学基金(50973048,21104058);天津市应用基础及前沿技术研究计划项目(12JQNJC01400)
作者:郭袈(1982-),女,硕士,讲师.
通信作者:张青松(1980-),男,博士,副教授.E-mail:zqs8011@163.com
原载: 天津工业大学学报2012/8;1-
【摘要】采用两步法,分别以无机纳米粘土硅酸镁锂(LMSH)和亚甲基双丙烯酰胺(MBA)作为异丙基丙烯酰胺(NIPAm)和氨基半乳糖丙烯酸衍生物(GAC)的物理和化学交联剂,制备得到全互穿的P(NIPAm/LMSH)/P(GAC/MBA)水凝胶;采用红外光谱、扫描电镜和称重法研究了全互穿水凝胶的化学结构、内部孔洞、(消)溶胀和温度脉冲响应性行为,并探索了凝胶表面的细胞活性.结果表明:全互穿水凝胶孔洞数量多,尺寸为20 30 µm;10 min内溶胀度增加1.4倍,失水率超过60%,并表现出良好的温度脉冲响应性,且随脉冲次数的增加,溶胀度逐渐下降;鼠成纤细胞(L929)培养结果表明2~8 d内水凝胶表面细胞数量逐渐增加,但低于聚苯乙烯组织培养板(TCPS)上的细胞数量。
【关键词】全互穿;水凝胶;异丙基丙烯酰胺;无机纳米粘土;细胞活性
【中图分类号】TQ427.26 文献标志码:A 文章编号:1671-024X(2012)04-0001-05
目前,组织工程研究的一个重要方向是关于通过和有关细胞群的相互作用诱导再生过程的支架的构思[1].水凝胶(hydrogels)是一种具有亲水性但不溶于水的高分子聚合物,在水中可迅速溶胀至一平衡体积而仍能保持其形状和三维空间网络结构.由于人体组织大多是由蛋白质和多糖网络组成的含有大量水的水凝胶材料[2],因而水凝胶已广泛应用于组织工程中[3-4].2002年,日本川村理化学研究所的Haraguchi研究小组[5-6]采用无机纳米粒子合成锂皂石(Hectorite)作为物理交联剂,制备得到透光率高、响应速率快、吸水溶胀率高(>3 000%)和拉伸强度大(>1 100 kPa)的纳米复合水凝胶.但若将纳米复合水凝胶用于组织工程还需
提高其生物相容性.陈莉等[7]研制了壳聚糖基温敏凝胶,与均聚温敏凝胶相比,壳聚糖的加入显著提高了鼠成纤细胞(L929)的贴附增值能力,同时,亲水性壳聚糖的引入提高了细胞片的脱附速率.半乳糖(CH2OH(CHOH)4CHO)是一种由6个碳和1个醛组成的单糖,归类为醛糖和己糖,可在奶类产品或甜菜中找到.在先前的研究中,本课题组先用乳糖酸(LA)和乙二胺反
应,合成出具有氨基反应活性的L-NH2,然后使L-NH2与丙烯酸(AAc)偶联,合成出具有双键的大单体GAC,然后在无机纳米粘土(硅酸镁锂,LMSH)的物理交联作用下,利用GAC中的双键与异丙基丙烯酰胺(NIPAm)进行自由基聚合制备得到无规共聚的P(NI-PAM/LMSH/GAC)水凝胶.研究发现,当GAC的质量分数(GAc/(GAC+NIPAM)增加到30%时,所得凝胶的溶胀度、消溶胀速率和力学性能等均大幅下降,因而难以用于组织工程中.为提高这一比例下凝胶的机械性能和响应速率,本文采用全互穿网络技术(IPN)和双交联剂(物理交联剂LMSH和化学交联剂MBA)两步法合成得到P(NIPAm/LMSH)/P(GAC/MBA)水凝胶,采用红外光谱(FTIR)、扫描电镜(SEM)和称重法研究了所得凝胶的结构、形态和溶胀行为,并采用噻唑盐(M1Tr)法研究了鼠成纤细胞(L929)在凝胶表面上的生长活性.
1 实验部分
1.1 实验原料
N-异丙基丙烯酰胺(NIPAM),分析纯,用甲苯-环己烷(体积比为60/40)混合试剂重结晶,东京化成公司产品;乳糖酸(Lactobionic acid,LA),分析纯,上海汇申
化工有限公司产品;丙烯酸(AAc),分析纯,天津市化学试剂研究所提供;硅酸镁锂(LMSH)[(Mg,Li) Si4O10(0H)2·4H20],石家庄资信佳科技有限公司产品;N,N-亚甲基双丙烯酰胺(MBA),甲醇重结晶,天津市科密欧化学试剂有限公司产品;过硫酸铵(APS),分析纯,天津市风船化学试剂科技有限公司产品;N,N,N,N-四甲基乙二胺(TEMED),国药集团化学试剂有限公司产品。
1.2 互穿水凝胶的制备
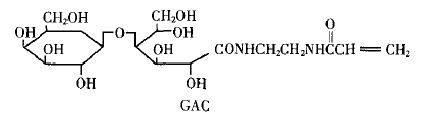
氨基半乳糖丙烯酸衍生物(GAC)的合成参见文献[8],其结构如图1所示。
采用两步法制备具有互穿结构的P(NIPAm/LMSH)/P(GAC/MBA)水凝胶.
|
|
|
图1 GAC的结构示意图 |
(1)纳米复合水凝胶的合成:将0.70 g异丙基丙烯酰胺(NIPAM)加至10 mL去离子水中,搅拌10 min后,加入无机纳米粉体硅酸镁锂(LMSH)0.14 g;待LMSH溶解之后,加入LMSH的稳定剂焦磷酸钠0.14g,待溶液变得澄清后,置于冰水浴中通入氮气;20 min后加入0.005 g引发剂过硫酸氨(APS),并用微量移液器移取700µL催化剂四甲基乙二胺(TEMED)加入反应液中,继续搅拌10 min;最后将反应混合物注入密封的玻璃模具中,将混合物体系静置于20℃的恒温环境中,反应48 h,得到PNIPAm纳米复合水凝胶,简称为IHGL0。
(2)互穿水凝胶的合成:将0.3 g GAC加入18 mL去离子水中,搅拌10 min后,加入化学交联剂亚甲基双丙烯酰胺(MBA)0.10 g;待溶解后,将IHGL0纳米复合水凝胶浸入其中;24 h后,将水凝胶移人模具中,降温至5℃以下;加人2 mL APS水溶液与1 mL TEMED,然后固定于恒温震荡器中,室温反应48 h得到互穿水凝胶IPN P(NIPAm/LMSH)/P(GAC/MBA),简称为IHGL30。
(3)无规共聚水凝胶的合成:作为对照,采用同样方法,在(1)中加入0.3 g GAC,制得无规共聚的P(NI-PAHl/LMSH/GAC)水凝胶,简称为HGL30。
1.3 表征和性能测试
(1)结构表征:用德国生产的TENSOR37型FTIR仪测定冷冻干燥样品的化学结构;用捷克公司生产的Quanta200扫描电子显微镜在10 kV加速电压下观察喷金后冷冻干燥样品的孔洞形态.
(2)溶胀度测试:将37℃溶胀平衡后的HGL30和IHGL30称重后放在20℃去离子水中,每隔一段时间取出并用滤纸拭干表面水,称重,如此反复直至溶胀平衡.不同时间所对应的溶胀度( )按公式(1)计算:
|
SR= |
mt-md |
(1) |
|
md |
式中:mt为t时刻的凝胶质量;md为37℃溶胀平衡后的凝胶质量。
(3)消溶胀度测试:将在20℃去离子水中达到平衡的水凝胶取出,用滤纸拭去表面水分,称重,迅速放入37℃的水中,间隔一定的时间,取出并擦净表面水分.称重.其水保留率(WR)由公式(2)计算:
|
WR= |
mt-md |
×100%
(2) |
|
mc-md |
式中:mc为凝胶溶胀平衡时的质量;md为干态凝胶质量;mt为t时刻的凝胶质量。当t=0时.mt= mc.
(4)温度刺激响应性测试:①将lHGL30和HGlJ30凝胶放入20℃水中,溶胀平衡后.取出并用滤纸擦干表面水分.称重;②然后放入37℃水中消溶胀,每间隔2min取出,并用滤纸擦干表面水分,称重;③经过10min后,立刻将凝胶放回20℃水中进行溶胀测试,每间隔2 min时间取出,并用滤纸擦干表面水分,称重;④经过10 min后,再放入37℃水中进行溶胀测试,重复步骤②,共测定90min.根据公式(1)计算不同时间和温度下的SR.
(5)细胞活性测试:将灭菌处理后的IHGl20和HGL20凝胶在无菌条件下放入96孔板各孔,接种鼠成纤细胞(L929),并放入含有5%CO2且温度为37℃的二氧化碳培养箱中进行培养.采用噻唑盐(MTT)法用酶联免疫检测仪表征细胞的活性,根据吸光度(OD)值的大小计算反应体系中的细胞增殖程度,选定波长为495 nm.以细胞培养板(TCPS)为对照组.
2 结果与讨论
2.1红外光谱分析
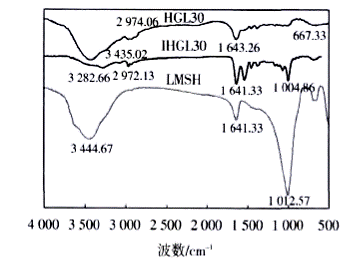
图2所示为无机纳米粉体LMSH、lHGL30和HGL30的红外光谱图.
|
|
|
图2
LMSH、HGL30与IHGL30水凝胶红外光谱图 |
由图2可见,LMSH在波数为l012cm-1处有一个很强的吸收峰,即Si-0伸缩振动峰,而和IHCL30水凝胶曲线上的l005 cm-1处同样出现了Si-0伸缩振动峰.就HGL30和IHGL30而言,2条曲线均含有PNIPAm主要基团的特征峰,如C=O伸缩振动(1 641 cm-1)、C-N伸缩振动和N-H弯曲振动(1 541cm-1)、CH3弯曲振动(1 368,1 386cm-1)等.此外.聚合前GAC在l 624cm-1处具有双键的特征峰,而在1HCL30水凝胶的曲线上消失了.由此可以推断GAC的双键打开,在化学交联剂MBA的交联作用下,生成P(GAC/MBA)聚合网络,并和P(NIPAm/LMSH)形成全互穿网络结构.
2.2 形态分析
图3所示为IHGL30和HGL30水凝胶样品的
2.2形态分析
图3所示为IHGL30和HGL30水凝胶样品的SEM照片(放大倍数为l200).
|
|
|
|
图3 IHGL30和HGL30水凝胶的扫描电镜图 |
|
由图3可见,HGL30水凝胶的孔洞尺寸小(1~5µm)、孔洞数量多.这是由于GAC和NIPAm两者为共聚方式,形成的网络结构比较致密.相比而言,LMSH和MBA作为双交联剂制备的IHGL30水凝胶的孔洞尺寸大(20~30µm)、孔洞数量少,且孔洞通透性好;此外,其孔壁较厚,兼具有MBA交联凝胶的性质.这是由于在第一步合成过程中首先制备得到大孔洞结构的P(NIPAm/LMSH)纳米复合水凝胶,因而IHGL30水凝胶主体上还保留着纳米复合水凝胶的孔洞形态,而化学交联剂MBA交联GAC时是在P(NlPAm/LMSH)纳米复合水凝胶孔壁上进行反应,因而在整体上保持大孔洞结构的同时,又增加了壁厚.
2.3 溶胀和消溶胀行为
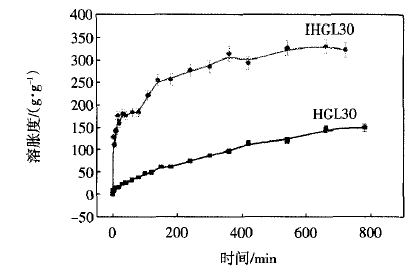
图4所示为IHGL30与HGL30水凝胶在2O℃水溶液中的溶胀曲线.
|
|
|
图4 IHGL30和HGL30在2O℃水中的溶胀度变化曲线 |
从图4中可以看出,IHGL30与HGL30水凝胶的溶胀速率和溶胀比都随着时间的增加而增大,均表现出一定的时间依赖性.但IHGL30水凝胶比HGL30水凝胶具有更快的溶胀速率和更高的溶胀度.在10 min时,IHGL30、HGL30水凝胶的溶胀度分别为142.64、15.16,IHGL30是HGL30水凝胶的9.40倍;在660 min
时,IHGL30是HGL30水凝胶的2.26倍.这表明全互穿后,MBA对于GAC的交联没有降低反而增大了SR,这个结果也是和图3相一致的.由于IHGL30具有更大的孔洞结构,因而可吸收更多的水,具体表现为高的溶胀度.
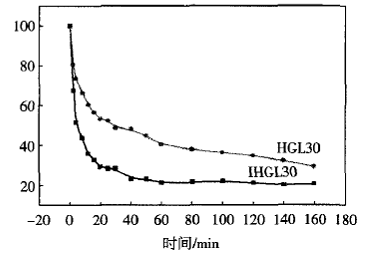
图5所示为IHGL30与HGL30水凝胶在37℃水中的消溶胀曲线.
|
|
|
图5 IHGL30和HGL30水凝胶在37℃水中的消溶胀曲线 |
由图5可见,相比于HGL30,IHGL30水凝胶的失水速度非常快,在不到10 min的时间内已经失去60%的水分,60 min后即基本达到平衡.这是由于I-HGL30的孔洞尺寸大,随温度增加和水凝胶体积的收缩,水分子可以更快地从孔洞中溢出,表现为快的消溶胀速率.
2.4 温度脉冲响应性
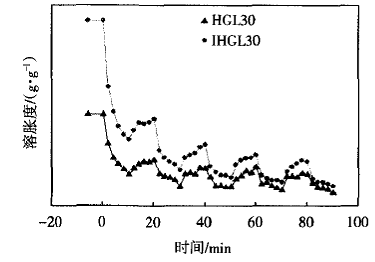
图6所示为IHGL30与HGL30水凝胶在2O℃和37 ℃交替刺激下的溶胀-消溶胀曲线.
|
|
|
图6 IHGL30与HGL30水凝胶在20℃和37℃交替 刺激下的溶胀一消溶胀曲线 |
从图6可以看出,在相同时间内IHGL30较HGL30凝胶对温度交替刺激表现出更快的响应性.I-HGL30凝胶内部具有更大的孔洞结构,因此在温度刺激下,水分子可以更快地进出凝胶的孔洞,而表现出
更快的刺激响应性.此外,IHGL30水凝胶消溶胀的速率快于溶胀速率.这是由于IHGL30凝胶在37℃时处于收缩状态,分子链间的距离较短,以疏水作用为主,因此凝胶溶胀时,水分子首先要克服这种作用才能进
入凝胶内部使其溶胀;而在2O℃时由于分子链和水分子间存在较强的氢键作用,造成分子链间的作用力降低,凝胶处于溶胀状态,高分子链的自由度较大,因而表现出快的溶胀速率.
相比于HGL30水凝胶在4次变温循环后的溶胀度差异不大,互穿后的IHGL30水凝胶在第2次消溶胀后就达到一个较低点,此后随着循环次数的增加,下降幅度变得缓慢.在前2次的消溶胀过程中,P(NIPAm/LMSH)网络受温度影响剧烈收缩,而随着循环次数的增加,凝胶基体中的P(GAc/MBA)网络开始起到阻碍作用,进一步的收缩受到限制,因而随脉冲响应次数的增加,SR下降幅度变得平缓.
2.5 凝胶表面的细胞活性
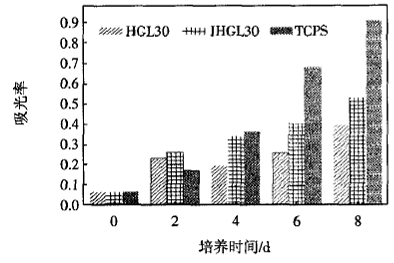
图7所示为L929细胞在TCPS板、IHGL30和HGL30水凝胶表面培养2~8 d后的细胞活性测试结果.
|
|
|
图7 在TCPS板、IHGL30和HGL30凝胶表面培养的 L929细胞活性检测 |
由图7可见,细胞在2类凝胶和TCPS板上的数目均随着时间的增加而增加,至第6~8 d时,细胞仍在增长,未发生因饱和而发生拥挤导致细胞死亡的情况.
总体而言,IHGL30和HGL30水凝胶上的细胞数量均不如TCPS板.对比IHGL30和HGL30水凝胶上的细胞生长状况可知,L929细胞在IHGL30凝胶上的第2、4、6和8 d的生长数量均优于HGL30水凝胶.这可能是由于:37℃下IHGL30收缩明显,疏水性高,L929细胞更易贴附生长;在HGL30中,无规共聚的PGAC分子链主要在凝胶基体内部,而在IHGL30凝胶中,GAC是浸泡在P(NIPAm/LMSH)纳米复合水凝胶的水溶液中,在表面的含量更多,从而可以促进L929细胞的增殖.
3 结论
(1)采用两步法制备得到具有全互穿结构的P(NIPAm/LMSH)/P(GAC/MBA)水凝胶,互穿后的水凝胶孔径尺寸为20~30 m、孔洞数量少,且孔洞通透性好.
(2)与共聚的P(NIPAm/LMSH/GAC)水凝胶相比,全互穿水凝胶的溶胀度增加2.26~9.40倍,在10 min内失去60%的水分,并具有良好的温度脉冲响应性.
(3)在2种凝胶表面进行鼠成纤细胞L929的培养,细胞数量均随培养天数的增加而增加,P(NIPAm/LMSH)/P (GAC/MBA)水凝胶能更好地促进L929的增殖.
参考文献:
[1]YIM E K F,LEONG K W.Significance of synthetic nanostructures in dictating cellular response [J].Nanomedicine,2005(1):10-21.
[2] OSADA Y,GONG J P. Soft and wet materials:Polymer gels[J].Advanced Materials,1998,l0(1 1):827-837.
[3]宫政,丁姗姗,尹玉姬,等.组织工程用水凝胶制备方法研究进展[J].化工进展,2008,27(11):1743-1749.
[4] 刘永,崔英德,尹国强,等.组织工程用蛋白基水凝胶[J].材料导报,2008,22(8):25-28.
[5]HARAGUCHI K,LI H J,MATSUDA K,et a1.Mechanism of forming organic/inorganic network structures during insitu freeradical polymerization in PNIPA-Clay nanocomposite hydrogels[J].Macromolecules,2005,38(8):3482-3490.
[6] HARAGUCHI K,LI H J,SONG L,et 1a.Tunable optical and swelling/deswelling properties associated with control of the coil-to-globule transition of poly (N-isopIl0pylacrylamide)in polymer-clay nanocomposite gels[J].Maeromolecules,2007,40(19):6973-6980.
[7] wANG J Y,CHEN L,ZHAO Y P,et a1.Cell adhesion and accelerated detachment on the su~ace of temperature sensitive chitosan and poly(N-isopropylacrylamide)hydrogels[J].Jour
nal of Materials Science:Materials in Medicine,2009,20(2):583-590.
[8] WANG J Y,XIAO F,ZHAO Y P,et a1.Cell proliferation and thermally induced cell detachment of galactosylated thermo-responsive hydrogels[J].Carbohydrate Polymers,2010,82:578-584.