转基因家蚕生产含蜘蛛丝蛋白的新型复合茧丝纤维yd15135
张袁松1,2,赵天福2,赵爱春2,文红秀2,中垣雅雄3 1.西南大学纺织服装学院,重庆400715;2.家蚕基因组生物学国家重点实验室(西南大学),重庆400715;3.日本信州大学纤维学部,日本长野县386-8567
收稿日期:2011-05-04 修回日期:2011-08-29
基金项目:中央高校基本科研业务费专项资金资助项目(XDJK2009B007);教育部第39批留学基金项目(教外司留[2010]1174号);教育部春晖计划资助项目(教外司留[2010]610号);人力资源和社会保障部留学人员科技活动优先资助基金项目(渝人社办[2009]l16号);西南大学博士基金项目(SWUB2007067)
作者简介:张袁松(1971-),男,副教授,博士。研究方向为新型纤维材料与功能纺织品。E-mail:yszhang@SWU.edu.en。
原载:纺织学报2012/5;1-5
【摘要】为了人工大量生产蜘蛛丝蛋白,蜘蛛牵引丝基因(MaSp1)被用piggyBac转基因载体导入家蚕染色体中。茧丝蛋白分析显示转基因家蚕可以生产含有蜘蛛牵引丝蛋白的复合茧丝新纤维。与天然茧丝相比,转基因家蚕茧丝强度增加5.3% ,而断裂伸长几乎没有变化。研究表明利用转基因家蚕大量生产各种新型复合蛋白质纤维材料具有潜在的应用前景。
【关键词】转基因家蚕;蜘蛛丝;复合蚕丝
【中图分类号】TS 102.3;Q 967 文献标志码:A 文章编号:0253-9721(2012)05-0001-05
蜘蛛在其生命期中可以通过各种腺体产生如下7种不同的丝蛋白:大囊状腺产的牵引丝(又名牵引丝、拖牵丝);小囊状腺产的框架丝;鞭状腺产的横丝;管状腺产的卵茧丝;集合腺产的横丝表面黏性物;梨状腺产的附着盘蛋白;葡萄状腺产的捕获丝[1]。这些丝蛋白在蜘蛛体内丝腺中是可溶性的蛋白质,大囊状腺分泌的牵引丝因其超高的强度和弹性而备受关注,牵引丝的断裂强度超过了同等直径的钢丝,断裂伸长率超过35% ,高于普通的蚕丝纤维[2]。作为天然生物材料,人们希望获得力学性能优异的蜘蛛丝,进而应用于工业、军事、医药等领域。蜘蛛丝牵引丝纤维由2种主要蛋白质构成,分别是MaSpl(major ampullate spidroin1)和MaSp2蛋白,它们构成蜘蛛丝的比例大约是3:2。这2种蛋白质分子量为300 kDa左右,其核心部分是由100个串联重复序列组成,每个串联重复序列由30~40个氨基酸组成,其中富含甘氨酸、丙氨酸的高度重复序列,大量的甘氨酸、丙氨酸重复区域被认为形成蜘蛛丝纤维的结晶区,为蜘蛛牵引丝的高强力做出贡献[3-4]。
为了获得大量的蜘蛛丝蛋白,研究人员进行了各种尝试,分别在大肠杆菌、酵母、植物、昆虫细胞、哺乳动物细胞、山羊等宿主进行了蜘蛛丝蛋白的表
达[5-8],文献[9]在家蚕细胞、幼虫中进行了表达,但是产量都不高,仅获得少量可溶解性的蜘蛛丝蛋白,要形成纤维还必须经过化学纺丝的方法,成本非常高。
家蚕在25 d的幼虫生长期内体重可增加1万倍,其中主要是进行蛋白质的合成,所以家蚕是高效的蛋白质生物反应器,在丝腺中合成大量液态的蛋白质,通过吐丝器在空气中形成固态的茧丝。研究结果显示,蜘蛛牵引丝(MaSp1)与家蚕的丝素重链(FibH)具有相似的高度重复核苷酸序列,其氨基酸组成非常接近[10]。蚕和蜘蛛的生物纺丝过程也有些相似,它们都是在常温常压下进行的液晶纺丝,而且都能通过纺丝器官控制丝的结构和特性。
近10年来,许多研究已经证明piggyBac转基因载体是一种相当有效的家蚕转基因工具,其方法已经比较成熟[11]。本文利用piggyBac载体将蜘蛛丝的牵引丝(MaSp1)基因导入家蚕染色体,探讨利用转基因家蚕生产含有蜘蛛丝蛋白的新型复合茧丝纤维。
1 实验部分
1.1 材 料
家蚕N4品种、piggyBac转基因载体和MaSp1抗体由日本信州大学纤维学部提供,幼虫25℃ 桑叶饲育。
1.2 实验方法
1.2.1 克隆家蚕丝素重链启动子和LBS序列
根据家蚕丝素蛋白的全基因序列设计了2对引物(primer),分别扩增家蚕丝素重链(FibH)启动子和LBS(L Chain Binding Site)序列。
1.2.2 转基因载体构建
在之前的研究中,已经获得了一段1.5 kb的亚洲络新妇蜘蛛(Nephila clavata)牵引丝(MaSp1)DNA序列[9]。通过基因工程的方法,构建了一个完整的在家蚕丝素重链(FibH)启动子引导下的蜘蛛丝牵引丝基因表达序列(命名为FibH-MaSp1-LBS)。
将这段完整表达序列导入piggyBac质粒构建转基因载体(piggyBac MaSp1),如图1中A所示。
|
|
|
注:两端的左斜线框代表piggyBac-MaSpl转座子的左右侧翼序列;3xP3为人工合成的一段核苷酸序列;SV40PolyA为猴空泡病毒40(SV40)的多聚腺苷酸序列(PolyA)。 |
|
图1 piggyBac-MaSpl转基因载体结构 |
1.2.3 piggyBac-MaSpl质粒载体的显微注射
将piggyBac-MaSpl质粒用超纯水调配成
0.4µg/mL,用钨针先在产卵3~6 h的家蚕蚕卵开1个小孔,然后用毛细玻璃针将转基因载体piggyBac-MaSpl质粒与Helper质粒一起注入蚕卵中,常温下让蚕卵孵化(GO代)。
1.2.4 转基因家蚕筛选
饲育GO代家蚕,待其化蛾、交配、产卵后,对G1代家蚕进行转基因筛选。用荧光显微镜对家蚕幼虫、蛹、蛾各个生长时期的眼睛进行观察,piggyBac转座子携带的红色标记蛋白(DsRed)会发出红色荧光,从而筛选出转基因成功的家蚕。
1.2.5 蚕茧中蜘蛛牵引丝蛋白的鉴定
将普通蚕茧和转基因家蚕蚕茧剪成碎片,用LiSCN完全溶解,所获得的蛋白质溶液用SDS.polyacrylamide gel electrophoresis(PAGE)进行电泳检测,然后用免疫反应(West blotting)验证蚕茧中存在蜘蛛丝蛋白。
1.2.6 复合茧丝纤维的力学性能测定
随机选取20粒普通蚕茧和转基因家蚕蚕茧为材料,对单根茧丝纤维进行强力和断裂伸长率的测定。测试仪器采用UTM-I11-100型强力仪(日本东洋Baldwin有限公司)。
2 结果与讨论
2.1 转基因载体的设计
本文设计的转基因载体如图1所示。丝素重链启动子(Fibroin
H promoter)引导整个蜘蛛丝基因在丝腺细胞表达,重链LBS(L Chain Binding Site)序列让蜘蛛丝MaSp1蛋白与轻链蛋白结合,同时LBS序列末端有polyA序列,使整个蜘蛛丝的表达终止,这样就人工合成了一个完整的表达单元,这个表达单元嵌入到piggyBac转基因载体的转座子部分(见图l中A)。
在转座子部分还有一个完整的红色荧光蛋臼(DsRed)的表达单元(见图l 中 B),它由3xP3启动子引导,SV40PolyA终止表达。3xP3启动予只在眼细胞中启动后续基因的表达,所以DsRed作为标记基因在家蚕各个生长时期只在眼细胞中表达DsRed荧光蛋白.在荧光显微镜下可以看到家蚕眼睛发出红色荧光,这是一个标记蛋白(Marker),可以作为转基因成功的依据[11]。
研究表明,家蚕的丝素重链(H Chain)蛋白C-末端的半胱氨酸必须与轻链(L Chain)的半胱氨酸通过二硫键结合在一起.才能形成完整的丝素蛋白[12]。由于本文采用家蚕的丝素重链蛋白(FibH)启动子引导蜘蛛丝蛋白的表达,所以必须在蜘蛛丝蛋白基因序列后面连接丝索重链基因末端的LBS蛋白基因序列后面连接丝素重链基因末端的LBS序列,该序列含有丝索重链C-末端的半胱氮酸和使丝素重链蛋白表达终止的polyA序列,这样才能构建一个由蜘蛛丝基因代替丝素重链基因的完整表达序列,所表达的蜘蛛丝蛋白才能够在家蚕丝腺细胞中与轻链蛋白结合。分泌到丝腺管腔中形成茧丝的丝素部分。
2.2 转基因效率
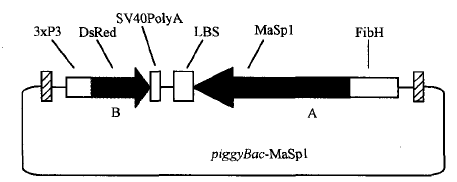
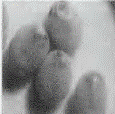
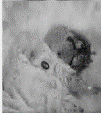
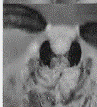
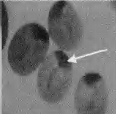
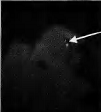
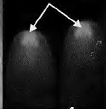
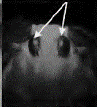
显微注射了1908粒蚕卵,有148粒孵化出GO代幼虫,GO代幼虫经过化蛹、化蛾、交配后产出G1代蚕卵56个蛾圈,Gl代蚕卵住孵化前3-4 d开始用荧光显微镜观察未孵化家蚕幼虫的眼睛(见图2中A),发出红色荧光的阳性有2个蛾圈,挑出阳性个体继续饲育。
转基因效率如表l所示:
表l 转基因效率
|
项目 |
粒数 |
|
G0代注射蚕卵数 |
1908 |
|
G0代孵化蚕卵数 |
148 |
|
Gl代产卵蛾圈数 |
56 |
|
G1代阳性蛾圈数 |
2 |
|
G1代阳性率/% |
3.57 |
其G0代孵化率只有7.8%。与未进行显微注射的普通家蚕孵化相比.显微注射对蚕卵造成一定程度的损伤。孵化率明显降低。最开始由于开孔过大,甚至出现G0代完全不孵化的情况,所以转基因效率与注射操作的熟练程度密切相关。GI代阳性个体有8头幼虫(分属2个度密切相关,Gl代阳性个体有8头幼虫(分属2个蛾圈),阳性率为3.57%。在蚕卵、幼虫、蛹、蛾等不同时期,都观察到眼睛发出稳定的红色荧光(见图2(b))。
|
|
A |
B |
C |
D |
|
a.光学显微镜照片 |
|
|
|
|
|
b.荧光显微镜照片 |
|
|
|
|
|
图注:A-蚕卵,B-5龄幼虫,C-蚕蛹,D-蚕蛾 图(b)中白色箭头批示发荧光的眼睛部位 |
||||
|
图2 转基因家蚕不同时期的荧光检测 |
||||
2.3 蚕茧蛋白质分析
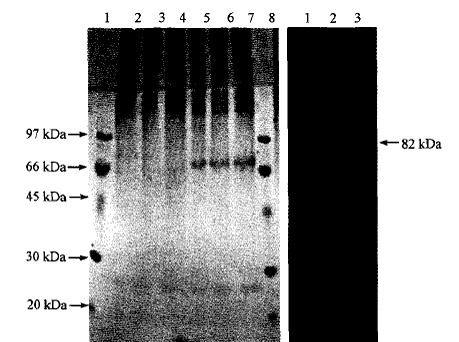
普通家蚕和转基因家蚕的蚕茧用LiSCN溶解后进行SDS·PAGE蛋白质分析.结果如图3(a)所示。
|
|
|
(a)SDS-PAGE
(b)免疫反应 |
|
图3 蚕茧蛋白质分析 |
图3(a)中l、8为低分子量标记蛋白(LWM),2~4为普通的N4家蚕蚕茧样品,5~7为转基因家蚕蚕茧样品.在转基因家蚕蚕茧中有一个82 kDa的蛋白条带,这与计算的蜘蛛丝MaSpl蛋白质分子质量一致,普通的家蚕蚕茧中没有这个蛋白条带。
用天然MaSp1蛋白抗体进行免疫反应.结果如图3(b)所示。转基因家蚕的后部丝腺(posl silkgland,PSG)和蚕茧蛋白样品都在相应的82 kDa位置出现了蜘蛛丝MaSpl蛋白免疫反应条带(1、3),而普通蚕茧在该位置没有反应(2)。这说明在转基因家蚕蚕茧中成功地表达了蜘蛛丝牵引丝蛋白(MaSp1)。转基因家蚕分泌的茧丝是一种含有蜘蛛牵引丝蛋白的新型复合茧丝。
2.4 复合茧丝力学性能
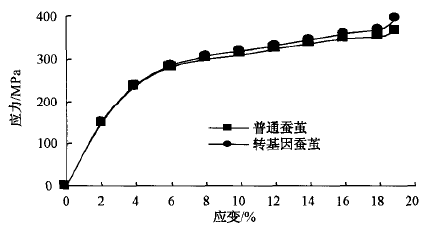
对普通蚕茧和转基因蚕茧的茧丝进行力学性能对比测试,计算平均值,结果如图4所示。
|
|
|
图4 复合茧丝纤维力学性能 |
普通N4品种冢蚕茧丝平均强度为376 MPa,断裂伸长率为19.2% ;转基因家蚕茧丝平均强度为396 MPa,断裂伸长率为19% 。转基因家蚕茧丝强度增加5.3% ,而断裂伸长率几乎没有区别。
高性能的蜘蛛丝纤维作为生物材料可以应用于工业、航空、医疗等领域,然而由于蜘蛛集中饲养有自相残杀的习性,所以无法像家蚕一样大规模人工饲养,在自然界中采集会使成本过高。因此,运用生物工程的方法大量生产蜘蛛丝蛋白就成了突破这一瓶颈的最佳选择。而利用家蚕生产含蜘蛛丝蛋白的复合茧丝纤维材料具有独特的优势:可以规模化饲养,成本低廉等[9]。本文将MaSp1基因由FibH启动子引导,通过piggyBac转座子整合进家蚕染色体中,实验证明蜘蛛丝蛋白在转基因家蚕的茧丝中得到表达。
家蚕茧丝由75%丝素和20% 丝胶组成,其中丝素由重链蛋白(FibH)和轻链蛋白(FibL)组成,许多研究用FibH、FibL和丝胶(sericin)蛋白质的启动子在家蚕丝腺中表达外源蛋白[13-16]。本文研究显示FibH启动子一样可以有效引导蜘蛛丝MaSpl蛋白的表达。同时,用微生物、山羊、烟草等其他宿主生产的蜘蛛丝蛋白需要一个人工纺丝的过程生成纤维,而利用家蚕丝腺生产纤维材料具有独特的优势,它可以通过家蚕的生物纺丝过程直接形成纤维。
目前复合茧丝的力学性能没有大的改善,这可能与复合茧丝中的蜘蛛丝蛋白比例过低有关(大约为3%);同时蜘蛛丝主要由MaSp1和MaSp2这2种蛋白质组成,它们以什么样的方式结合共同为蜘蛛丝的高性能做贡献,还有待研究。今后可以从研究蜘蛛丝蛋白与蚕丝蛋白的比例、相互关系入手深入研究这2种蛋白质再生形成的新纤维材料的性能和机制。
3 结论
利用piggyBac转基因载体,将家蚕重链启动子(FibH promoter)引导下的蜘蛛牵引丝MaSp1蛋白表达单元导入家蚕染色体中,得到转基因成功的家蚕。通过免疫实验证明转基因家蚕分泌了含有蜘蛛丝蛋白的复合茧丝。尽管复合茧丝的力学性能没有明显改善,但研究表明,利用转基因家蚕大量生产各种新型复合蛋白质纤维材料具有潜在的应用前景。
参考文献:
[1] RISING A,NIMMERVOLL H,GRIP S,et a1.Spider silk protein mechanical property and gene sequence[J]Zool Sci,2005,22:273-283
[2] Hu x,VASANTHAVADA K.KOHLER K.et.a1.
Molecular mechanisms of spider silk[J]Cell Mol Life Sci.2006,63:1986-1999
[3] XU M,LEWIS R V. Structure of protein superfiber spider dragline silk[J].Proc Natl Acad Sci USA,1990,87:7120-7124.
[4]HIMAN M B. LEWIS R V. Isolation of a clone
encoding a second dragline silk fibroin Nephila clavipes dragline silk is a two-protein fiber[J].J Biol Chem,1992,267:19320-19324.
[5]FAHNESTOCK S R,IRWIN S L. Synthetic spider dragline silk proteins and their production in Escherichia coli[J].Appl Microbiol Biotechnol,1997,47:23-32.
[6]FAHNESTOCK S R, Bedzyk L A. Production of synthetic spider dragline silk protein in Pichia pastoris[J]. Appl Microbiol Biotechnol,1 997,47:33-39.
[7]SCHELLER J, GUHRS K H , GROSSE F, et a1.Production of spider silk proteins in tobacco and potato[J].Nat Biotechnol,2001,19:573-577.
[8]TEULE F, COOPER A R, FURIN W A , et a1. A protocol for the production of recombinant spider silklike proteins for artificial fiber spinning[J].Nat Protoc,2009(4):341-355.
[9]ZHANG Y, HU J, MIAO Y, et a1. Expression of EGFP-spider dragline silk fusion protein in BmN cells and larvae of silkworm showed the solubility is primary limit for dragline proteins yield[J]. Mol Biol Rep,2008,35:329-335.
[10]ZHANG Y, SHIMIZU K, SHIOMI K, et a1. cDNA cloning of Nephila clavata dragline silk(MaSp1)gene and comparison with the sequence of Bombyx mori fibroin heavy chain[J].Sanshi.Konchu Biotec,2008,77:39-45.
[11]TAMURA T,THIBERT C,ROYER C,et a1. Germline transformation of the silkworm Bombyx mori L. using a piggyBae transposon—derived vector[J].Nat Biotechno1.2000,18:81-84.
[12] TANAKA K,INOUE S,MIZUNO. SHydrophobic interaction of P25,containing Asn-linked oligosaccharide chains. with the H-L complex of silk fibroin produced by Bombyx mori[J].Insect Biochem Mol Biol,1999,29:269-276.
[13]段建平,徐汉福,马三垣,等.人脑源性神经营养因子基因(hBDNF)在转基因家蚕丝腺中的特异表达[J].蚕业科学,2009,35(2):248-252.
[14]李春峰,黄科,甘进锋,等.转植酸酶基因家蚕的制作及表达检测[J].昆虫学报,2009,52(7):713-720.
[15]TOMITA M ,HINO R,OGAWA S,et a1. A germline transgenic silkworm that secretes recombinant proteins in the sericin layer of cocoon[J].Transgenic Res,2007,I6:449 -465.
[16]ZHAO A,ZHAO T,ZHANG Y,et a1.New and highly eficient expression systems for expressing selectively foreign protein in the silk glands of transgenic silkworm[J].Transgenic Res,2010,19(1):29-44