有机螯合剂及其环保型品种的开发yd14609
陈荣圻 上海纺织职工大学
原载:“中大·洁润丝”上海印染新技术交流研讨会论文集(2011年度);200-211
【摘要】近一半左右的染整加工疵品是因为水质中的钙土金属和重金属产生的,通过实践解决的办法是在前处理,染料,印花和后整理工艺处方中添加螯合剂以去除有害金属离子。本文就螯合剂的络合稳定常数lgK 和螯合容量两大指标性参数的有关问题入手介绍氨基羧酸类,膦酸盐类,羟基羧酸类,氨基酸类和聚羧酸类五大有机螯合剂。重点评述因生态环保问题将退出市场的NTA、EDTA、DTPA 而取而代之的有机膦酸盐类螯合剂,虽然在制造过程中涉及甲醛,但如经妥善处理残留在纺织品上的甲醛将低于国内外有关法规的可控限量之内,而且不会造成水体富营养化。
【关键词】有机螯合剂;络合稳定常数;螯合容量;应用开发
雨水中因为不含任何金属离子,是天然的软水。但雨水从地表渗出后,能从它流经的土壤和岩石中吸收金属离子。若雨水流经软质岩石如石灰石,它能溶解这些矿物质,当溶解更多的钙,镁,碱土金属后,水的硬度就会变大。水中含有一些会影响生产工艺的有害元素,其中钙,镁,铁,锰的存在会产生比较严重的问题。
染整加工产品的疵病中大约50%是因水质不好而造成的,水中钙土金属和重金属离子会与其它物质发生各种化学反应而造成疵病。因为从前处理的退浆,煮练,漂白和染色,印花,后整理无不在水中进行,所以要清除疵布形成的根源需从水质处理着手,而螯合剂是起看重要的不可取代的功能。
1. 螯合剂在前处理工艺中的应用
⑴退浆工艺中的应用
钙,镁,重金属离子与浆料反应形成溶解度很小的钙,镁,重金属盐或络合物,经烧毛后在织物上形成难溶的浆膜,尤其是PVA 浆因吸附金属离子而凝胶化而降低在水中溶解度,金属离子也不利酶退浆。退浆液中加入螯合剂可将金属离子络合,提高了浆膜的可溶性,也提高了浆料与退浆剂的反应,从而较易使浆料从织物上去除,退浆率明显提高。
选用络合常数高,络合容量大的螯合剂,退浆效果较好。螯合分散剂的退浆效果不如螯合剂,但可使浆料更易膨化,脱离纤维并分散成胶体状而去除。同时可防止浆料再次沉积在织物上,因此可以两者复配组成。
⑵煮练工艺中的应用
钙、镁离子可与煮练水解产物的高碳羧酸结合成难溶的羧酸盐,并牢固地吸附在棉纤维上,很难清除。甚至形成阻染作用的钙斑,造成染色不匀。
在煮练液中加入螯合剂和螯合分散剂可以克服以上问题,有利于水解产物的去除,也有利于去除果胶及棉籽壳。一般在水硬度不是很高时,选用螯合分散剂为宜,足以将水中钙、镁离子络合,其分散性又可将金属络合产物分散在水中而不沾污到织物上去。如果水质硬度很高,则需将螯合剂和螯合分散剂复配作用。
⑶漂白工艺中的应用
铁离子(Fe2+ 、Fe3+)催化双氧水加速分解,造成纺织品在漂白过程中局部过度氧化,使纤维损伤直至产生破洞。用螯合剂作为氧漂稳定剂后将铁离子络合以控制双氧水分解速度。
螯合剂还能去除使织物泛黄元凶的锰离子,Mn2+和Mn4+都是强氧化剂,会使织物氧化而泛黄。当水中的锰离子浓度超过3mg/kg 时,就出现织物泛黄,随着锰离子浓度增加而泛黄程度急剧上升[2]。练漂后的杂质易吸附在纤维上很难洗除,特别是冷轧堆工艺,因所用药剂浓度高,浴比小,杂质吸附更严重。在洗液中加入螯合分散剂可以大大提高洗涤效果。它的作用是络合水中的钙、镁离子,防止它们与练漂杂质结合成不溶性的沉淀,并使已洗除的杂质分散在水中而防止再沾污。
2. 螯合剂在染色工艺中的应用
含有磺酸基和羧酸基水溶性基团的活性染料,直接染料,酸性染料,因为钙、镁离子可能与二个或二个以上这类水溶性基团给合成不溶性的钙、镁离子,一方面降低染料在水中溶解度,同时形成大分子而导致染料对纤维的扩散性下降而造成染色不匀,由此也使染色物色降萎暗。因此,硬水是造成水溶性染料染色不匀和色泽萎暗的主要原因。解决方法是在染液中加螯合剂。但是遇到金属络合染料,不宜选用络合稳定常数高的螯合剂,以免将金属络合染料中的重金属取出来,而造成色相变化和牢度下降。
分散染料由于在高温下染色,某些基团如CH2CH2OCOCH3、-CH2 CH2 COOH3 、-CN- NHCOCH3 ,以及偶氮基等容易发生水解和还原反应,造成色浅和色变。染浴中重金属离子(Cu2+、Fe2+)会促使上述反应[3]。水中的Ca2+、Mg2+能将分散染料微粒外层所包覆的阴离子型分散剂(木质素磺酸钠、萘系磺酸甲醛缩合物)沉淀而破坏其分散性,导致染料颗粒凝聚而影响上染,降低给色量。添加螯合分散剂有助于匀染,但要选用耐高温的螯合分散剂。
其他染料的染浴中加入螯合剂可阻止某些蒽醌型分散染料,活性染料和酸性染料,因络合金属离子而产生色变和色萎;防止还原染料的过氧化,清除金属离子对其隐色体的影响;也能防止金属离子对硫化染料的色光变化;不溶性偶氮染料的重氮盐因受微量Cu2+、Fe2+催化破坏,加入螯合剂可以阻止这些金属离子的作用;涂料染色时可以防止涂料颗粒之间因分散剂被破坏而凝聚,造成染浴不稳定和匀染性降低。
活性染料染色洗除浮色是提高染色物牢度的重要步骤,在皂洗液中添加螯合剂的目的是避免浮色染料与钙、镁离子形成不溶性的色淀而使浮色难以洗除,以及浮色再沾染在织物上。
3. 螯合剂在印花工艺中的应用
印花浆中的染料浓度很高,染料溶解度直接影响印花质量,水质不好影响更大,印花浆内添加螯合剂可降低因水质原因所造成的影响。活性染料印花时用海藻酸钠作为增稠剂,在硬水中生成不溶性钙盐,造成印花后处理时洗除困难。印花浆中的防还原剂间硝基苯磺酸钠(防染盐S)的溶解度本来不高,在硬水中水溶性更低,在印花烘干过程中成为固体状沉淀在织物上,汽蒸时难以抵御蒸汽中的还原性气体,导致色泽变化。在螯合剂存在下,染料溶解度得以提升,得色量增加,印花产品色泽鲜艳,并有助于印花后残浆的洗除。
4. 螯合剂的阻垢作用
硬水中的碳酸钙和其他金属离子来源造成的沉淀,沉在织物上影响其吸水性,进而影响后道加工,最后影响织物的手感和白度。在设备上结垢形成的沉垢,影响设备的功能;沉淀在热交换器上,影响传热效率,管道被堵,阀门失灵,从而影响设备正常运转;沉积在设备布辊上,造成织物擦伤。垢体大多为结晶体,以碳酸钙为例,CaCO3 具有离子晶格,是由带正电荷的Ca2+与带负电荷的CO32-相碰撞时彼此结合,并按一定的方向,具有严格排列的硬垢。当加入螯合剂后对Ca2+的螯合作用抑制了晶格向一定方向成长,CaCO3 垢的晶体结构发生畸变,而不再继续按正常规则继续增长。产生的是一些较大的非结晶颗粒,其中部分吸附在晶体上。随着晶体的增长而进入晶格中,使CaCO3 晶体发生错位,在垢层中形成一些空洞。即使仍有部分晶体在长大。也难以形成紧密的垢层,从而使CaCO3 硬垢转变为软垢,易被水流冲去[4]。
聚羧酸类螯合分散剂是一类线性高分子化合物,除了羧酸基一端吸附在CaCO3 晶粒上,其余部分围绕在晶粒周围,使晶体无从增长,晶粒变得细小。形成松软的垢层,易被水流冲洗掉。有机膦酸类螯合剂只需几个mg/L 就可以阻止几百个mg/L 碳酸钙沉淀。因此阻垢性能优良。
二、螯合剂的络合稳定常数与螯合容量
化合物中具有可供配位的孤独电子对的分子、原子或离子能够与具有空轨道的金属形成配键的称为改化合物为络合物,如若能与配位金属离子形成环状结构的化合物称为螯合剂,形成的络合物称为螯合物。螯合剂中至少含有一种孤独电子对,而金属离子必没有空的价电子轨道。孤独电子对填充入金属离子空轨道,电子对金属两个原子共享,形成配位键,中心金属离子空轨道杂化。根据不同的提供孤独电子对的配位体与不同金属离子形成正四面体,正八面体的螯合物。
1. 螯合物的络合稳定常数
配位体与中心金属离子形成络合物或螯合物后,中心金属离子失去原有金属离子的性质。两者之间形成一个平衡反应。
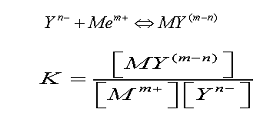
Y:配位体, M:金属离子, K:络合物稳定常数
稳定常数大的络合物,解离为原来的配位体和金属离子的浓度很低,该络合物就愈稳定,反应向形成络合物的方向进行。因为络合物稳定常数K 一般都很大,常用它的对数值来表示,即lgK 表示。各种金属离子与不同配位体(螯合剂)的络合稳定常数lgK 列于表1 中[5]
表 1 各种螯合剂与不同金属离子的稳定常数lgK
|
金属离子 |
NTA |
HEDTA |
EDTA |
DTPA |
|
Fe3+ |
15.87 |
19.87 |
25.10 |
28.60 |
|
Cr3+ |
24.00 |
|
|
|
|
Sn3+ |
11.51 |
15.39 |
16.90 |
22.34 |
|
Al3+ |
10.89 |
16.11 |
|
|
|
Hg2+ |
20.10 |
21.78 |
26.27 |
|
|
Cu2+ |
13.16 |
17.55 |
18.79 |
21.10 |
|
Ni2+ |
11.54 |
17.00 |
18.56 |
21.21 |
|
Pb2+ |
11.39 |
15.50 |
18.30 |
18.60 |
|
Zn2+ |
10.66 |
14.50 |
16.69 |
18.30 |
|
Co2+ |
10.40 |
14.40 |
16.21 |
18.40 |
|
Cd2+ |
9.80 |
13.00 |
16.61 |
18.93 |
|
Fe2+ |
8.83 |
11.60 |
14.33 |
16.55 |
|
Mn2+ |
7.44 |
10.70 |
13.98 |
15.50 |
|
Ca2+ |
6.56 |
8.51 |
10.85 |
10.74 |
|
Mg2+ |
5.41 |
7.00 |
8.69 |
9.02 |
|
Sr2+ |
4.98 |
6.80 |
8.63 |
9.68 |
|
Ba2+ |
4.82 |
6.20 |
7.76 |
8.63 |
|
Ag+ |
5.40 |
7.30 |
|
|
|
Na+ |
2.15 |
1.66 |
|
|
表 1 中NTA 为氨三乙酸钠,HEDTA 为羟乙基乙二胺三乙酸三钠,EDTA 为乙二胺四醋酸,DTPA 为二乙烯三胺五醋酸。
+3 价金属离子的原子核外电子层分布为(n-1)d2ns1np3(n 为最外层电子的主要子数),六个空轨道混合起来,形成d2s1p3 变化轨道为正八面体杂化轨道,可以容纳配位体中6 对孤独未共电子对。如果全部充满,形成的络合物最稳定,d2s1p3 杂化轨道为正八面体杂化轨道。这些杂化轨道分别于配位原子的孤电子轨道在一定方面上彼此接近,发生最大重叠而形成配位键,构成正八面体的络合物[6]表1 中的Fe3+、Cr3+即为这类重金属离子lgK 最大。
Cu2+、Ni2+、Co+2、Mn2+等正二价重金属离子与配位体生成络合物时,4 个空轨道d1s1p2 变化生成的杂化轨道可以容纳配位体中4 对未共孤电子对,dsp2 杂化轨道为正四方形,由dsp2 杂化轨道形成的络合物,其lgK 仅次于+3 价金属离子的正八面体,也比较稳定。
同为正二价的钙土金属Ca2+、Mg2+离子的外层电子层分别为4s4p3 与3s3p3 四个空轨道,同时形成配位数为4 的络合物时,只能采取sp3 杂化轨道成键,构型为正四面体,[7]与dsps2 杂化轨道形成的正四方形构型相比,络合稳定性稍低。
因此,表1 中对4 种螯合剂,按lgK 值次序都是相似的,即Fe3+>Cu2+>Ni2+>Zn2+>Mn2+>Ca2+>Mg2+。NTA、HEDTA、EDTA、DTPA 与钙、镁离子有较强的螯合能力,络合后形成螯合环结构,都是sp3 变化轨道配位键结合,构型为正四面体。EDTA(二钠)与Ca2+、Mg2+离子的络合物如下:
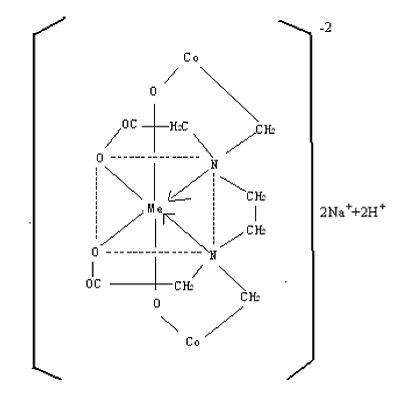
NTA 的配位原子除了三个乙酸钠为氧原子,另一个为氮原子,其电荷性为3.4,稍逊于氧原子的电荷性3.5,因此lgK 稍低,HEDTA 因为其中一个配位体为羟乙基,离解程度不如乙酸,所以lgK 低于DETA 和DTPA。
络合稳定常数lgK 可以作为络合剂(或螯合剂)对各种金属离子络合效率的指标性数据。络合物的形成原则上是根据lgK 大小顺序进行,在一个溶液中如含有多个金属离子,则首先络合lgK 大的,如果络合剂过量,再络合lgK 较次的金属离子。反之,如若溶液中只有一种金属离子,而存在多种络合剂,则必然先与lgK 大的络合剂进行络合。
2. 螯合容量
微量螯合剂效率的另一个指标是螯合容量,或称螯合值,螯合力,是以1g 螯合剂能螯合Ca(以CaCO3 计)的毫克数,有时以CaV 表示。用络合滴定法测试。优良的螯合剂不但络合稳定常数大,螯合容量也要大,加入少量螯合剂达到螯合多量金属离子。
3. 温度与 pH 值对lgK 和螯合值的影响
染整加工是在不同温度和pH 值环境下进行的,螯合剂要求保持优良的络合状态,需要考虑温度与pH 值对lgK 和螯合值有何影响
(1) 温度影响
络合稳定常数lgK 一般随温度升高而下降,但影响程度不大,所以温度对lgK 的影响一般可以忽略。但是温度升高对于螯合剂结合钙的能力有影响,不同螯合剂的影响程度不同。[8]表2 为各种螯合剂在两种温度下的螯合容量。
表 2 各种螯合剂在两种温度下的螯合容量(mg/g)
|
螯合剂名称 |
20℃ |
90℃ |
|
三聚磷酸钠 |
154 |
113 |
|
羟基乙叉二膦酸(HEDP) |
394 |
378 |
|
二偏磷酸钠 |
114 |
28 |
|
氨基三磷酸钠 |
224 |
224 |
|
氨基三乙酸钠(NTA) |
265 |
202 |
|
2-羟基亜氨基二乙酸 |
145 |
91 |
|
乙二胺四乙酸(EDTA) |
219 |
154 |
|
1,2,3,4-环戊烷四酸钠 |
280 |
235 |
|
柠檬酸 |
195 |
30 |
|
羟甲基酒石酸 |
248 |
123 |
|
羟甲基氧代琥珀酸 |
368 |
54 |
表 2 可见,HEDP 在温度从20℃升高到90℃基本不变,柠檬酸和酒石酸,琥珀酸的衍生物只能在低温下使用。
(2)pH 值的影响
螯合剂与金属离子形成螯合物,在不同的pH 值情况下,其络合稳定常数是不同的。所以选用螯合剂的最重要因素要考虑溶液的pH 值,同一个螯合剂在不同的pH 值时,其螯合性能完全不同。例如EDTA 在pH<3 时,几乎不能将Ca2+、Mg2+离子螯合,而对Fe3+、Cu2+离子,即使pH=1 时,仍能定量地进行螯合反应。而pH 值>12 时,EDTA 完全失去络合能力。[5]表3 为各种金属离子被EDTA 螯合的最佳pH 范围。
表3 EDTA 与各种金属离子螯合时的最佳pH 值范围
|
金属离子 |
pH 值 |
金属离子 |
pH 值 |
|
Ca2+ |
8~13 |
Fe2+ |
5~6 |
|
Mg2+ |
9~11 |
Fe3+ |
1~4 |
|
Mn2+ |
5~8 |
Co2+ |
3~10 |
|
Cu2+ |
2~10 |
Pb2+ |
4~10 |
|
Ni2+ |
3~12 |
Hg2+ |
3~6 |
|
Al3+ |
2~5 |
Zn2+ |
4~10 |
Ca2+ 、Mg2+在碱性条件下进行螯合,Fe3+在酸性条件下进行螯合,Cu2+在较广的pH 值范围内螯合,每一个螯合剂对金属离子螯合都有最适宜的pH 值范围。
溶液的pH 值对螯合容量也有影响[8]。表4 为螯合剂的螯合容量与pH 值的依赖性对不同金属离子的最适宜pH 值范围内的螯合容量。
表 4 各种螯合剂对不同金属离子的螯合容量与pH 值的依赖性
|
金属离子 |
NTA |
EDTA |
DTPA |
HEDTA |
|
Ca2+ |
140-156 mg/g (pH10~11) |
140 mg/g (pH8.5~11.5) |
104 mg/g (pH8~11) |
116 mg/g (pH8~11) |
|
Mg2+ |
95 mg/g (pH8~10) |
65 mg/g (pH8.0~10.5) |
55 mg/g (pH8.5~10.5) |
70 mg/g (pH10~12) |
|
Cu2+ |
245 mg/g (pH1~12) |
165 mg/g (pH2~13) |
125 mg/g (pH3~11) |
185 mg/g (pH3~11) |
|
Fe3+ |
215 mg/g (pH1~3) |
145 mg/g (pH1~6) |
115 mg/g (pH2~7) |
165 mg/g (pH2~10) |
从表 4 可见,络合常数最低的NTA,它的螯合容量却超过另三个螯合剂。各种螯合剂与不同金属离子螯合反应的最适宜pH 值与表3 基本一致。
三、现用螯合剂的性能评述
螯合剂是能与多价金属离子络合形成五元环或六元环的可溶性金属络合物的配位体化合物,有无机类和有机类两种。无机螯合剂以多聚磷酸盐为代表,如三聚磷酸钠,其缺点是高温下会分解,使螯合能力降低,甚至消失。只适合与碱性介质,对铁离子的络合能力很差。只能用于硬水的软化。这类螯合剂使水体富营养化而导致水体污染。已逐渐被淘汰。有机类螯合剂发展迅速,品种逐年增加。成为螯合剂的主流,有机螯合剂的种类众多。有二氨基羧酸类,有机磷酸类,聚羧酸类等。
1. 氨基羧酸类
有机螯合剂以氨基酸类应用最早,如乙二胺四乙酸(EDTA)和乙二烯三胺五乙酸(DTPA)作为金属络合剂和氧漂稳定剂使用。但是目前人们担心的是它们和重金属离子形成稳定的高度水溶性的金属络合物进入废水中,会在环境中残留毒性的重金属离子。经长期研究,EDTA 的老鼠口服急性半致残量LD50 为2600mg/kg,为低毒物质,短期接触对鳟鱼能耐受最高450mg/L 的浓度,属低毒物质。
但它的生物降解性较低,其金属络合物更低。2002 年5 月欧盟将EDTA 和DTPA 列为禁用物质,历史上曾用NTA 取代,因为NTA 比EDTA 和DTPA 能很快生物降解,但是后来发现NTA 为怀疑性致癌物质,因此必需寻找取代品。能生物降解且无毒性的螯合剂是当前的研究开发热点,在氨基羧酸类中有二个品种介绍如下:
(1) N,N –二羧酸氨基-2-羧基丙烷基磺酸钠,分子结构式如下:
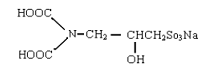
对金属离子的螯合容量大于NTA,易生物降解,可用作为氧漂稳定剂,对双氧水有很好的稳定作用。
(2) 3-羟基-2,2‘-亚氨基二琥珀酸四钠(HIDS),分子式结构如下:
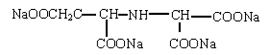
鱼毒性LC50>2000mg/L,易生物降解。对Ca2+的lgK=4.8,Fe3+ lgK=12.5,螯合容量cv 值=300mg CaCO3/g。在pH值广泛范围内对各种金属离子形成可溶性的络合物特别是Fe3+ pH 4~8 时,0.01mol HIDS可以络合0.01mol Fe3+达100%;在pH 11 时,还能达到83%。而EDTA 在pH 4~6 时,络合Fe3+ 85%,pH 8~10 时为58%,pH 时仅50%。随pH 值的升高,螯合容量明显下降,而HIDS 无明显变化。HIDS在碱性溶液内在80℃时放置20 小时后,稳定性仍良好,在碱中溶解度远高于NTA 和EDTA,因此特别适用于氧漂pH 值10.5~11 的环境。
2. 有机膦酸盐类
有机膦酸盐类螯合剂是应用较广泛的螯合剂之一,国内氧漂稳定剂中大多是以这类螯合剂作为主要组分,它们具有良好的化学稳定性,不易水解,能耐较高温度,适合双氧水热漂,对钙、镁、铜、铁等离子有优异的螯合能力,有如一些品种
(1)1- 羟基亚乙基-1,1-二膦酸(HEDP),俗称二甲叉,分子结构式如下:
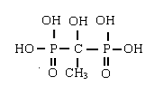
HEDP 是一个五元酸,它在水中可电离出5 个氢离子,离解常数pK1=1.7,pK2=2.47,pK3=7.28,pK4=10.29,pK5=11.13。电离后形成5 个配位氧原子,可以和Ca2+ 、Mg2+、Fe2+、Fe3+、Cu2+、Zn2+、Al3+形成稳定螯合剂,它们的络合稳定常数lgK 分别为6.04, 6.55, 9.05, 16.21, 12.48, 10.37 和15.29[9]。螯合容量为≥400mg/g(以CaCO3 计),铁螯合容量≥1000mg/g。
小白鼠皮下注射LD50=486.4mg/kg,低毒性。
HEPP 的热稳定性很好,在200℃以下能与上述金属离子螯合,在260℃pH=11 时经历12 小时,只有5.6%分解。
根据以上HEPP 有关性能,非常适合氧漂工艺环境内使用,阻垢效果也异常优良。
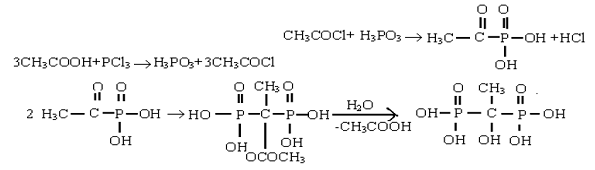
HEDP 是由三氯化磷和冰醋酸为原料,反应历程如下:[10]
(2)氨基三亚甲基膦酸(ATMP),俗称三甲叉。
HEDP 在较高温度下(125±2℃),脱水聚合成磷酸酯的低聚物,反应如下:
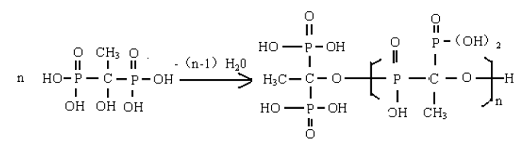
聚膦酸酯是一种既具有吸附又有螯合功能的氧漂稳定剂,分子结构中含有磷酸基羟基等空间配位基团。它与羟基丙烯酸高聚物(AR 750)相比,由于羟基丙烯酸的电离常数pK≈4;而聚膦酸酯的磷酸第二和第三电离常数分别为pK2=7.20,pK3=12.36.后者比前者小得多,因此与金属离子螯合更为稳定。
聚磷酸酯氧漂稳定剂商品是与Hg2+复配后,与之络合而形成高度分散的胶体物。其稳定机理是聚磷酸酯的镁盐络合物中Mg2+是一个共价性很强的缺电子体,在氧漂液中是一个电子接受体。而双氧水在碱性介质中电离为活泼的HOO-,HOO-的电子云密度很高,是一个富电子体,易于聚膦酸酯的镁盐络合物结合。HOO-被吸附在络合物的胶体上,使HOO-失去活动能力,从而仰制了HOO-继续分解。
![]()
一旦织物上遇到具有还原性物质或热的条件,又易与织物上色素氧化而去除。
聚膦酸酯的镁盐络合物的络合稳定常数比其它重金属离子所形成络合物的络合稳定常数低很多。例如HEDP 与Mg2+lgK=6.4,与Cu2+的lgK稳=19.0,与Fe3+ lgK稳为21.6.因此,聚磷酸酯镁络合物可以被Cu2+ 与 Fe3+取代而形成更为稳定的螯合物,从而消除了Cu2+ 和 Fe3+对双氧水的催化分解作用,降低双氧水分解速度达到稳定作用。
聚膦酸酯在95℃~100℃热漂时,耐碱50g/L,30℃~35℃冷堆时,能耐碱100g/L,5mg/kg Fe3+存在下仍有很好的稳定作用。漂白成品手感柔软,白度可与水玻璃稳定剂相媲美。是一种较为理想的氧漂稳定剂。
它是由三氧化磷水解为亚磷酸后与氯化铵和甲醛在酸性介质中一步合成。[10]
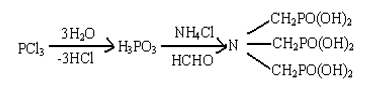
化学稳定性很好,不易水解。钙螯合容量≥450mg/g,铁螯合容量≥900mg/g,可以作为氧漂稳定剂
的组份。
(3)乙二胺四亚甲基磷酸(DETMP),俗称四甲叉,分子结构式如下:
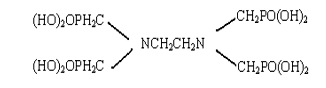
它是以三氯化磷,乙二胺和甲醛为原料,乙二胺羟甲基化后与三氯化磷水解产物亚磷酸反应制得。[10]
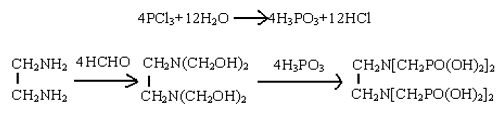
能与两个金属离子络合,无毒、无污染,化学稳定性良好,耐高温,在水溶液中能解离出8 个离
子作为配位体,因此与两个金属离子络合而形成大分子网状螯合物,分散于水中。钙螯合容量≥200mg/g,
铁螯合容量≥500mg/g。常用与配制氧漂稳定剂。
(4)二乙烯三胺五亚甲基膦酸(HTPMP),俗称五甲叉,分子结构式如下:
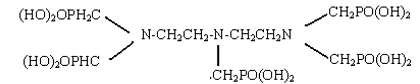
它是以二乙烯三胺与甲醛反应羟甲基后再与三氯化磷水解后的亚膦酸反应。[10]
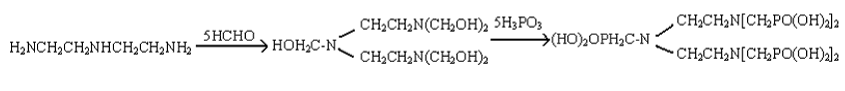
无毒性,易溶于酸性介质中,耐一定量的碱,耐高温,钙螯合容量≥522mg/g,铁螯合容量≥850mg/g。常用于配制氧漂稳定剂。
(5)三乙烯四胺六亚甲基膦酸(TETHMP),俗称六甲叉,分子结构式如下:
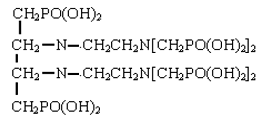
它是由六亚甲基四胺羟甲基化后与亚磷酸反应而得。[10]
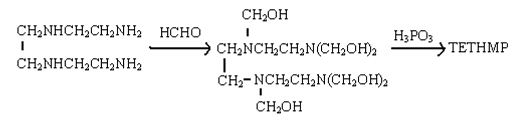
易溶于水,在水中离解度很高,可以产生12 个负离子作为配位体,可与三个金属离子络合形成一
个大分子网状螯合物,与Ca2+、Mg+形成非常稳定的螯合物。热稳定性很高,能耐223~245℃高温,易
生物降解,很安全,不污染环境。
(6)双(1,6-亚已基)三胺五亚甲基膦酸(BNHMTPMP),分子结构式如下:
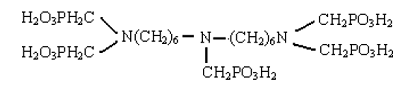
能在较为宽广的pH 范围内,120℃时有极佳的水溶性,可作为氧漂稳定剂和染色螯合剂。
(7)多氨基多醚基四亚甲基膦酸(PAPEMP),分子结构式如下:
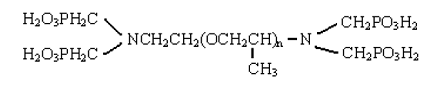
因含有聚氧丙烯基而提高其分散能力,具有很高的螯合分散性,特别适用于高硬度,高碱度水质应用,是新一代的水处理剂。能有效地螯合铜、猛、锌、铁等重金属离子,也可用与耐碱的氧漂稳定剂,和防止漂白布泛黄的螯合剂。
以上这些甲叉膦酸酯类螯合剂对水解不敏感,都是通过与金属离子的sp3 杂化轨道构成四面体的螯合物,对氧化剂的敏感性较NTA、EDTA、DTPA 及羟基羧酸类为小,络合稳定常数lgK 如表5 所示。
表 5 部份甲叉膦酸脂螯合剂与金属离子的稳定常数lgK
|
螯合剂 |
Ca2+ |
Mg2+ |
Fe3+ |
Cu2+ |
|
ATMP |
6.9 |
6.5 |
14.6 |
17.4 |
|
HEDP |
7.1 |
6.4 |
21.6 |
19.0 |
|
EDTMP |
9.3 |
8.6 |
19.6 |
23.2 |
|
DTPMP |
7.1 |
6.4 |
|
19.5 |
甲叉膦酸酯类螯合剂都是通过脂肪胺类与过量甲醛经过羟甲基化后再与亚磷酸酯化反应而制得,所以产品中是否存在残留甲醛,值得注意。这类螯合剂虽然是膦酸酯衍生物,但不会像无机磷酸盐使水体富营养化。因为膦酸酯通过亚甲基相连,而C-P 的键能为246KJ/moL,离解能达1387 KJ/moL,比较牢固,因此很难使单体磷进入水体中造成富营养化。
3. 羟基羧酸类
羟基羧酸类中的柠檬酸,酒石酸,葡萄糖酸含有相当数量的羟基和羧基作为配位基可与金属离子络合作为螯合剂。但在酸性条件下羟基与羧基不会离解为氧负离子,因而络合能力很弱,不适宜在酸性介质中应用。柠檬酸和酒石酸在低温下有较好的螯合容量,而温度升高则大幅度下降(见表2)。葡萄糖酸钠是一种重要的螯合剂,pH 值越大其螯合能力越强,而且螯合铁(Fe3+)的能力特别强,但螯合Ca+2 的能力不强。pH=12 时对Fe3+螯合容量为636.4mg/g,对Ca+2 的螯合容量只有55mg/g,适合高碱浓度下作为氧漂稳定剂的组成。
4. 氨基酸类
聚天门冬氨酸(Polyaspartic Acid, PASP)是近年来合成的一种生物高分子,它具有水溶性聚羧酸的性质,已引起越来越多的重视,[11]它的分子结构式如下:
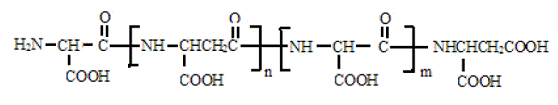
聚天门冬氨酸的相对分子质量分数分布很宽,从一千到数十万不等,[11]在纺织工业一般应用相对分子质量都在15000 以下。[12]
PSAP 的半致死量LD50≥10g/kg,无毒性,易生物降解,对环境无污染,是一类绿色螯合剂。对Ca2+有优良的螯合性能,但是对Mg2+,Fe3+的螯合能力较弱,单独使用存在一定局限性,通过合理复配,可以发挥两种螯合剂之间的协同作用,例如:利用PASP 对Ca2+有很强的螯合能力,而聚丙烯酸类螯合分散剂对Ca2+的螯合能力最弱;PASP 对Mg2+,Fe3+的螯合能力很弱,聚丙烯酸类螯合分散剂则很强,因此将这两种螯合剂从一定比例复配后,两者取长补短,充分发挥复配增效作用,对Ca2+,Mg2+,Fe3+
具有综合性能,[13][11]具有良好的阻垢作用。温度升高使这两种螯合容量都下降,复配后的螯合剂也产生相同效应。如表6 所示
表 6 PASP 与聚丙烯酸类螯合剂的螯合容量(mg/g)
|
|
PASP |
聚丙烯酸类螯合剂 |
||
|
常温 |
65℃ |
常温 |
65℃ |
|
|
CaCO3mg/g |
549.01 |
280.77 |
117.51 |
35.67 |
|
Mg(OH)2mg/g |
100.19 |
4.31 |
187.23 |
137.35 |
|
Fe(OH)2mg/g |
53.79 |
4.82 |
74.18 |
22.91 |
5. 聚羧酸类
聚羧酸类螯合分散剂以丙烯酸或马来酸酐为单位的单一单体的均聚物或该二单体的共聚物为主,[14][15][16]也有与其他单体的共聚物,成为当前应用最广的系列产品。
聚羧酸是一类既有螯合力又有分散力的螯合分散剂。主要因为聚羧酸分子中有大量羧酸存在。羧基氧原子具有形成配位键的能力,相邻羧基能与金属离子形成螯合环而稳定存在于水中,同时因吸附在水中悬浮物上,增加螯合物分子表面负电荷,提高在水中的分散稳定性。[17]
(1)聚丙烯酸(PAA)
聚丙烯酸的性质和用途决定于它的分子质量。分子质量为200 到800 的PAA 为低分子质量的电解质,具有螯合分散作用;分子质量在2000~5000 的PAA 为最佳范围的螯合分散剂;分子质量在103~104的PAA 用作洗涤剂的助洗剂,可以取代因富营养化而禁用的三聚磷酸钠,其助洗作用可提高5 倍,[18]而且对环境影响很小;[19]分子质量为104~106 的PAA 用作合成增稠剂;分子质量为106~107 的PAA 用作于增稠剂和絮凝剂;分子质量>107 的超高分子量的PAA 不溶于水,只是在水中溶胀而成凝胶,用作吸水剂,所以染整工业用作用螯合分散剂的都是低分子量PAA。
低分子量的PAA 之所以有分散作用是因为它被悬浮颗粒所吸附,使悬浮颗粒表面带有双电层,
颗粒之间产生相同负电荷的斥力,克服颗粒相撞时的聚集力,从而达到分散作用,防止悬浮颗粒的凝聚。分子质量为2000~5000 的PAA,在浓度为20ppm 时,分散效率可达93%左右。PAA 的螯合力随分子量的增加而下降,低分子量的PAA 对钙、镁离子的螯合力达不到普通螯合力的一半。对铁离子的螯合力更差。但其分散力是其它螯合剂无法比拟的。因此低分子量PAA 适用于水质硬度不高而要求有良好分散性的煮练和染色中使用,常与其它螯合剂复合的取长补短的良好效果。
(2)水解马来酸酐(HPMA)
水解马来酸酐的分子结构式如下:
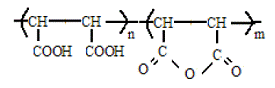
是聚马来酸酐部份水解产物,相对分子量>300,分子质量400~800 为低分子量HPMA,其金属离子螯合能力比PAA 强,而分散能力比PAA 弱;2000~5000 时的分散力增强。化学稳定性和热稳定性高,分解温度在300℃以上。适合于碱性介质中应用。无毒,生物降解性良好。
(3)丙烯酸-马来酸酐共聚物(PAA-PMA)
丙烯酸与马来酸酐共聚物有嵌段聚合和接近均聚物的产品,性能也有差异,以小间隔嵌段聚合物的效果较好,两者配比不同,性能差异很大。一般来说,丙烯酸含量越高,共聚物的分散能力越好,而马来酸酐的含量提高,其螯合能力随之增强,因此可以根据需要进行配比的调节。一般在丙烯酸与马来酸酐的摩尔比为1:1~1.5:1 时对Fe3+和Ca2+的螯合能力最好。但在马来酸酐单体的比例增大的同时,共聚反应程度下降。
PAA-PMA 产品兼有良好的分散性能和螯合性能,对钙、镁离子的络合力强于铁离子,适合染色时使用,也可以作为净洗时的助洗剂使用。
聚羧酸类螯合分散剂品种有全酸型,半钠型和全钠型成为系列,根据使用介质pH 值选用,可在退煮漂和染色时作为螯合分散剂使用。
(4)PAA-PMA 螯合分散剂与其他螯合剂的复配
由于单一螯合剂在使用中常存在一些局限性,通过合理复配,可以发挥螯合剂之间的协同增效作用。例如表6 中所示各种螯合剂的性能,葡萄糖酸钠和HEDP 对Fe3+的螯合能力特别强,但是对于Ca2+的螯合能力特别弱;ATMP 对Fe3+和Ca2+的螯合能力很均衡而一般;PAA-PMA 共聚物对Fe3+和Ca2+之相比都较差,但具有分散能力。将其合理复配后可以达到很好效果。
表 6 各种类型螯合剂的螯合容量
|
螯合剂 |
Fe3+(mg/g) |
Ca2+(mg/g) |
|
葡萄糖酸钠 |
636.4 |
55.0 |
|
HEDP |
586.3 |
120.0 |
|
ATMP |
251.0 |
298.0 |
|
PAA-PMA 共聚物 |
117.7 |
114.2 |
如以 PAA-PMA 共聚物68%;葡萄糖酸钠4.8%,HEDP 98%复配后Fe3+螯合容量为385.4mg/g,
Ca2+ 148.54mg/g;PAA-PMA 共聚物30%;葡萄糖酸钠5%,ATMP 50%复配后的Fe3+螯合容量为
261.7mg/g,Ca2+ 262mg/g。三者合理复配后,其螯合容量必然超过单一螯合剂的螯合容量,[20]而由于PAA-PMA 共聚物的介入,复配螯合剂的分散力明显提高。
通过以上实例,可以根据不同需要进行螯合剂复配以求最佳效果。
参考文献
[1] 夏建明,陈晓玉,任恩, 络合剂及其在印染行业的应用[J], 印染助剂,2000.17(3):6~9
[2] Zeronian S. H., Inglesly M. K., Bleaching of cellulose by hydrogen peroxide[J], celluose,1995.2:265~272
[3] 陈荣圻,超细纤维染色用染料及助剂(二)[J],印染,1994.2:42~44
[4] 周革,吴爱莲,陈晓玉,螯合分散剂在染整加工中阻垢机理的探讨[C], 2007 年浙江省纺织印染助剂第17 届年会,2007:27~31
[5] 黄茂福,化学助剂分析与应用手网[M],北京,中国纺织出版社,2001.11:1173~1181
[6] 陈荣圻,染料化学[M],北京,纺织工业出版社,1989.2:116~119
[7] 大连工业学院无机化学教研室,无机化学(第二版)下册[M],1982.8:198~208
[8] 李伟,螯合剂的特性与作用[J],中国印染协会信息,2009.7:53~55
[9] 周革。夏建明,螯合分散剂原料—HEDPA 性能,制造及其制品在印染等行业的应用[C],2007 年浙江省印染助剂情报网年会论文集,2007:1~7
[10] 周学良,精细化工助剂[M],北京,化学工业出版社,2005.5:248~253
[11] Michael Schamlorn, Chemical synthesis of polyaspartates:a fiode-gradalle alternative to currently used polycarloxylate homo and copolymers[J], Polymer Degradation Stalility,1998.59:39~45
[12] 方莉,谭天伟,聚天门冬氨酸的合成及其应用,化工进展,2001.3:24~28
[13] 邢富强,刘学,环保型螯合分散剂FJ-11 的性能研究,2008 年浙江省纺织印染助剂第18 届年会,2008.5:184~187
[14] 大森关三,丙烯酸酯及其共聚物[M], 北京,化学工业出版社,1995:95~132
[15] 严瑞宜,水溶性高分子[M],北京,化学工业出版社,1998:196~222
[16] 陈一飞,低分子聚丙烯酸在染整上的应用,郑州纺织工学院学报,2001.2:28~30
[17] 徐寿昌,工业冷却水处理技术[M],北京,化学工业出版社,1984:247~258
[18] 赵勋国,聚丙烯酸盐是一种有效的洗涤助剂[J],日用化学工业,1986.5:46~48
[19] 冯卫华,梁梦兰,洗涤剂中聚羧酸盐对环境的影响[J], 日用化学工业,2000.3:34~?
[20] 王镁,殷蕾,朱国华,环保型螯合分散剂的研制[M],2003 表面活性剂技术经济文集,大连,精细与专用化学品编辑部,2003:167~169。