光催化剂应用于环境净化yd14406
摘自:节能减排新途径与新技术;上海市经济团体联合会 (作者), 上海市化学化工学会 (作者) / 2010.05
摘者注:原书章节编号,小标题均稍有改动。红色方括号[]内的数字是原著中的页码,便于读者查对。黑色方括号[]内的数字是原文的文献索引号,该参考文献本文没有列出。
一、光催化作用概述
1 光催化作用原理
[199]
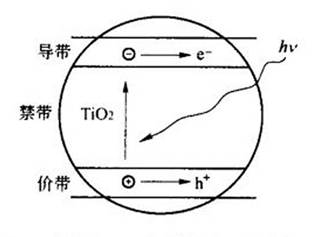
具有光催化特性的分子,在受光照时,价带中的电子就会被激发到导带,在导带形成高活性的电子(e-),同时在价带相应产生一个带正电的空穴(h+),即生成电子-空穴对(见图7.23)[115]。
被激活的电子和空穴可能在TiO2颗粒内部或内表面附近重新相遇而发生湮灭,将它们的能量通过辐射方式散发掉(e-+h+→辐射能),如图7-24所示。
|
|
|
|
图7.23光激发TiO2生成电子-空穴对示意图 |
图7.24 激活的电子和空穴在TiO2颗粒中活动示意图 |
在电场的作用下,电子与空穴发生分离,迁移到粒子表面的不同位置。热力学理论表明,分布在TiO2表面的空穴可以将吸附在其表面的OH-和水分子氧化成OH·(自由基)。
缔合在TiO2表面的OH·,氧化能力是水体中存在的氧化剂中最强的,能够氧化大部分的有机污染物及部分无机污染物,将其最终降解为CO2、H2O等无害物质,并且OH·对反应物几乎无选择性,因而在光催化氧化中起着决定性的作用。
TiO2表面高活性的电子具有很强的还原能力,可以还原去除水体中的重金属离子。但电子也极易与空穴复合,使光催化效率降低,若体系中存在电子接受体,则可降低空穴与电子的复合率,提高催化效率。
由于纳米级的TiO2粒径小,表面原子多,增大了表面光生载流子的浓度,使光催化效率大大提高;由于纳米TiO2的比表面积大,吸附能力强,TiO2表面吸附的OH-、H2O增多,使反应效率提高;由于TiO2的氧化还原电位也发生变化,由激发而产生的价带空穴具有更正的电位,导带电子具有更负的电位.使氧化还原能力增强。因此,选择纳米级TiO2作为光催化剂具有明显的优越性。其净化机理归纳如下:
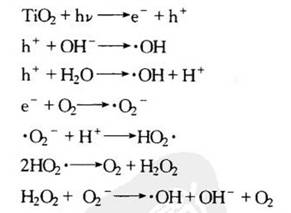
其中(·OH)为氢氧自由基;(H2O2)为过氧化氢;(·O2-)为超氧负离子。
2 光催化杀菌机理
TiO2微粒本身对微生物和细胞无毒性,只有TiO2形成较大的聚集体才对微生物和细胞[200]有毒性。例如,0.03~10 µm尺寸范围的TiO2聚集体对海拉细胞(He La cell,50 µm)无毒,而20 µm的TiO2聚集体由于沉积和包覆在这些细胞表面,而将其杀死。光激发TiO2首先破坏细胞壁、细胞膜,或细胞的组成成分发生生化反应,导致功能单元失活而致细胞死亡。TiO2光催化杀灭微生物细胞有两种不同的生化机理。
首先,光激发TiO2和细胞的直接反应。即光生电子和光生空穴直接和细胞壁、细胞膜或细胞的组成成分反应,使细胞呼吸作用衰退而引起细胞的死亡。因此,TiO2的光生空穴具有非常强的氧化能力,光激发TiO2可直接氧化细胞壁、细胞膜或细胞内的组成成分,从而杀死细胞。
另一机理则是光激发TiO2与细胞的间接反应,即光生电子或光生空穴与水或水中的溶解氧反应,形成氢氧自由基和过氧化氢自由基等活性氧类。它们与细胞壁、细胞膜或细胞内的组成成分发生生化反应。光激发TiO2颗粒产生的·OH和H2O2参与了杀灭细胞的过程。另外,这些活性氧类·OH或H2O2导致DNA链中的碱基之间的磷酸二酯键的断裂,引起DNA分子单股或双股断裂,破坏DNA双螺旋结构,从而破坏细胞的DNA复制以及细胞膜的代谢。
3 光催化的空气净化作用
利用纳米TiO2的光催化作用,可将来源于汽车尾气与工业废气中的CO、NOX与SO2气体氧化,形成蒸气压低的硝酸或硫酸,这些硝酸或硫酸可在降雨过程中除去,从而达到降低大气污染的目的。
煤燃烧时也会产生SO2,如果在燃烧的同时加入一种纳米级助燃催化剂,可以使煤充分燃烧,不产生CO;使硫转化成固体的硫化物,不产生SO2,能源利用率也提高了。传统的烟气脱硫技术脱硫剂难以再生,不仅运行成本高,而且越来越多的脱硫剂废弃物既浪费了土地资源又对环境造成了二次污染。李大骥等[116]提出用低温烧结的纳米级TiO2作为烟气脱硫剂,其中晶面衍射最强的锐钛矿型TiO2除了以物理吸附的方式吸附SO2之外,也催化了其表面因水化而富含羟基和被吸附SO2之间的反应生成H2SO3和H2SO4,在烧结温度为540℃时的吸附能力为27.1 mg SO2/g TiO2,再生后吸附容量仍可以达到19.5 mg SO2/g TiO2,这说明该纳米脱硫剂具有良好的再生能力。
据报道,在透水性多孔混凝土砌块表面7~8 mm深度内掺入50%以下的TiO2微粉制成的混凝土对浓度为1×10-5的NOX具有很好的去除能力,去除率达80%。若将此砌块用于公路铺设,可有效去除汽车排出尾气中的NOX,明显改善大气质量。
用纳米TiO2制得的环保涂料,在室外太阳光作用下对NOX光催化降解率很高,NOX几乎被全部降解,即使在室内自然光很弱的紫外光作用下,纳米TiO2光催化大气净化涂料对低浓度的NOX的氧化降解效果也很好。
日本已开发出应用于汽车车内气体净化装置,以TiO2为光催化剂清除车内有害气体,并已获得专利。日本石原公司与丰田汽车公司和Equos研究公司联合开发成功利用TiO2光催化反应高效率地除掉空气中的有害成分如NOX、甲醛等,此项新技术是在TiO2中添加特殊的氧化助催化剂,其净化能力约为现有TiO2的3倍。富士电机综合研究所则利用TiO2制成对低浓度的NOX进行分解的空气净化器,并制成除臭的冷藏车等供市场需要。
近年来随着室内装修热也带来了室内的空气污染,有害气体主要是装饰材料等放出的甲醛及生活环境中产生的甲硫醇、硫化氢、氨气等,这些气体在百万分之几时即能使人产生[20l]不适感。纳米TiO2通过光催化作用可将吸附于其表面的这些物质分解氧化,从而使空气中这些物质的浓度降低。减轻或消除环境不适感。
以具有直通孔的成型支承体胶粘活性炭(AC)为复合载体,采用浸涂法在复合载体上形成TiO2光催化剂薄壳层,制备出可用于室内空气净化的活性炭-纳米TiO2光催化净化网[117]。对其净化性能实验结果表明,以功率为6 w、波长为254nm的紫外杀菌灯照射3
h,其甲苯净化率为98.8%,三氯乙烯(TCE)净化率为99.5%.硫化氢净化率为99.6%,氨气净化率为96.5%,甲醛净化率为98.5%.一氧化碳净化率为60.1%。通过对比试验还表明,复合型空气净化网具有单纯活性炭、单纯光催化剂TiO2、活性炭与二氧化钛简单混合等净化网所不具备的综合优势,通过复合提高了光催化效率,同时达到活性炭原位再生的目的,体现出纳米复合材料的优良性能:
纳米TiO2以其优异的光催化性能,成为环保产品开发研究的热点之一。但目前纳米TiO2在使用过程中存在的主要问题是:(1)光触媒TiO2是微粒状的物质,粒子的颗粒愈小时,其表面积愈大,能吸收的光能越多,效果也越好。通常TiO2需要在纳米级,才能有足够的表面积进行光触媒反应。但颗粒越小所需要的制作成本越大,现在有些制造厂为了降低成本而采用微米级的光触媒,效率大打折扣;(2)太阳能利用率低,大部分光触媒二氧化钛必须有紫外线光照射才能起作用,能量消耗很大,因而从经济角度看,如何提高纳米TiO2的光催化效率,缩短反应所需的时间是一个急需解决的问题。目前在普通日光下,甚至是黑暗条件下也能抗菌的纳米TiO2材料已经研制成功,但需要进一步验证;(3)负载技术,纳米氧化钛产品为粉体状,因此寻找既能保持高催化活性又能维持负载材料的物性,而且能均匀、牢固地使催化剂固定在负载材料表面的技术是十分困难的,目前纳米TiO2的合成工艺稳定性控制技术还不够成熟,制备技术还不够先进。这些问题都有待于进一步研究解决,相信通过对纳米TiO2性能应用的不断研究,纳米TiO2的光催化性能必将具有更加广阔的应用。
二、光催化剂
2.1 引言
半导体光催化是一门集电化学、材料学、光学、表面化学和催化化学于一体的综合性学科,它主要的研究内容就是将光能转化为人类能够直接使用的其他能源例如化学能、燃料能源等。其主要途径是通过半导体材料有效吸收光能后,内部的电子空穴对被激发从而产生具有极强氧化能力和还原能力的光生空穴和电子,在催化剂表面发生直接、间接氧化或还原反应[1]。从20世纪60年代末开始半导体多相光催化作为一个新兴的研究方向得到了持续不断的发展,特别是在1972年Fujishima[2]发现了TiO2半导体电极在光照射下光解水的作用后,引发了全球光催化的研究热潮。
2.2 光催化基本原理[3-4]
半导体内部的能带结构是由一系列离散的能带组成的,它们的导电能力介于绝缘体与导体之间。区别于导体内部连续的能带结构来保证电子的自由迁移,半导体需要外部的各种能量激发来助其克服不连续的能带之间的势差,从而使电子能够顺利地迁移并最终使电子与空穴分离开并由此产生相当强的氧化还原性。半导体价带与导带之间的空域被称为禁带。以TiO2为例,锐钛矿相晶体的禁带宽度为3.2 eV,金红石相为3.0 eV。
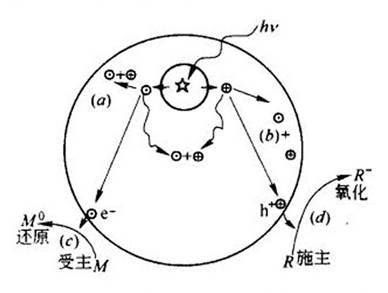
当半导体受到能量大于等于其能隙的光照射时,价带上的电子受激发跃迁到导带,产生电子-空穴对,空穴可以夺取催化剂表面被吸附物质或溶剂的电子,使得原本不吸收光的污染物被氧化,而电子则可使得吸附在催化剂表面电子受体被还原,其激发过程见图7-l。包括电子-空穴的激发过程(A),电子-空穴表面的复合过程(B),电子-空穴的体内复合过程(C),电子还原表面吸附有机物的过程(D)和空穴氧化表面吸附有机物的过程(E)。其中D和E过程是整个光催化过程中的有效过程。
|
|
一般在多相光催化反应中,空气或水是反应介质。这是由于光催化反应中产生的光生空穴和电子很难被反应物直接利用,而是需要依靠氧气或水分子产生性质活泼的自由基基团而得以进行[5]。以在水溶液中为例,在受光照激发后,产生电子-空穴对,同时被激发的电子和空穴又能重新复合释放能量(式(7-1),式(7-2))。一部分未复合的空穴,由于其本身具有很强的氧化性,可以将水中的H2O和OH一氧化成为具有强氧化性的羟基自由基·OH(式(7-3),式(7-4)),而一部分未复合的电子也会和催化剂表面吸附的氧分子反应,产生超氧离子自由[99]基·O2-(式(7-5)),而且它也是表面羟基自由基的另一个来源(式(7-6)~式(7-9))。由此可见,在一系列的反应中,产生了羟基自由基(·OH)、超氧离子自由基(·O2-)以及·OOH自由基这类具有很强氧化性的活泼自由基,因而可以将各种有机物直接氧化为CO2或H2O等无机小分子。

从上述反应可知界面间的电荷转移效率取决于两个关键过程,一是载流子之间的复合与被捕获过程的竞争(皮秒到纳秒级);二是已捕获载流子与界面间电荷转移的竞争过程(微秒到毫秒级)。因此增加载流子的寿命和提高界面电荷转移速率可有效提高光催化量子效率。
2.3 光催化剂在环境净化中的应用
近年来由于化学工业不断蓬勃发展,化工产品及其衍生物与人类社会发展之间的联系已经变得越来越紧密。但是生产和使用化工产品的过程中随之而来的废气、废液、废渣等三废污染物使得生态环境变得日益恶化,并且这一现状已经严重威胁到人类的生存与发展[6]。在Fujishima报道了光解水产氢的研究后不久,1977年Frank等将半导体光催化材料应用于催化光解污染物并且取得了突破性进展[7],之后光催化氧化在多种有机和无机污染物的处理方面得到了广泛研究[8-10]。光催化技术不仅可以应用于处理污水中的污染物,还在废气净化处理中有着广泛的应用,在处理室内建材、家具等散发的有毒有害气体,光催化材料的高效、无毒、无副产物、可以重复利用等优势已得到广泛认同[11-12]。同时光催化材料由于具有对大肠杆菌等细菌的抑制和杀灭作用亦可作为抗菌材料应用于建材、涂料等行业。
2.4 光催化剂需要解决的问题
光催化反应利用半导体材料在光照射下产生光生电子和空穴,实现氧化和还原反应,具有节能、环境友好等优点,在环境净化等领域显示出广阔的应用前景。TiO2由于价廉、无毒以及高热稳定性而成为首选光催化剂[12-13]。但纯TiO2光催化剂在实际应用中存在如下缺陷:
①光生电子和空穴容易复合,导致量子效率较低[14-15];②TiO2半导体的导带和价带能隙较宽(3.O~3.2 eV),因此TiO2光催化剂只能被短波长(<387 nm)的紫外光激活[16-18],而辐射到地面的紫外光部分仅占太阳光的5%左右,显然TiO2利用太阳能的效率很低;③TiO2光催化剂的比表面积较小,市售P25的比表面积只有45 m2/g左右.不利于光的吸收和对反应物的吸[100]附,导致光催化活性较差。虽然减小催化剂粒径可以提高比表面积。但粒子过细将带来分离困难,而且在粒径小于16 nm可能发生光散射现象,因此存在很大局限性。
3. 光催化剂的制备技术
近年来围绕提高光催化效率开展了大量工作,主要研究集中在TiO2的掺杂改性,先后报道了贵金属、金属离子、非金属元素掺杂型。TiO2[19-21]以及两元或多元复合氧化物TiO2[22-23]。同时也发展了一系列非钛光催化剂[24-27]。从光催化剂设计上来说,催化剂的结构和组成同等重要,通过改变制备方法,在组成相同的条件下,调变催化剂的结构也是提高光催化性能的一条有效途径。目前光催化剂的制备方法包括溶胶-凝胶法(Sol-Gel法)[28-31]、水热法[32-33]、沉积法[34-35]、超声波技术[36-37]、微波技术[38-39]等。上海师范大学近年来通过引进超临界技术、醇解技术、溶剂蒸发诱导表面活性剂自组装以及喷雾干燥技术等,设计了一系列新型结构的TiO2及其修饰型光催化剂和非钛光催化剂,其在光催化降解有机污染物中的催化性能明显优于传统方法制备的光催化剂,下面将简要介绍在此方面的工作进展。
3.1 超临界技术应用于光催化剂的制备
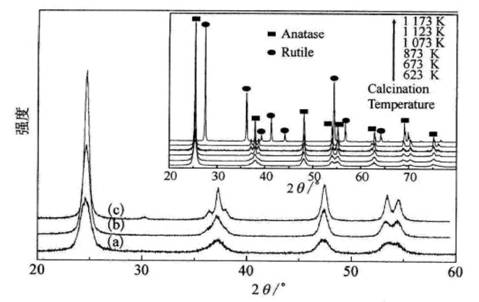
超临界条件下,气液两相的相对密度一致,此时气液差别消失,具有下列特性[40-41]:①可控相行为,由于不存在相界面,可消除表面张力;②高溶解能力,可克服界面阻力,有利于提高萃取和分离效率,③高扩散行为,超临界流体黏度小,传质系数大,不仅能够在表面和孔道内扩散,而且能够进入固体材料的骨架;④高压环境有利于获得高结晶度固体材料,乙醇为介质的超临界条件约为13 MPa和550 K,CO2为介质时,超临界条件约为8 MPa和350 K。采用Sol-Gel法制备TiO2凝胶,在乙醇介质中进行超临界处理,获得的TiO2能够保持前躯态中的孔道结构,比表面积可达到78 m2/g左右,而且未经焙烧就呈现高结晶度的锐钛矿相。同时,锐钛矿热稳定性大幅度提高。与传统方法(Sol-Gel获得前躯体,再进行焙烧)获得的TiO2相比。相转变温度提高250℃以上。在紫外光照射下,所制备的TiO2在光催化降解苯酚反应中的活性接近P25[42-43],远远高于传统Sol-Gel法制备的TiO2。在超临界流体中添加NH3、(CH3CH2)3N、CS2、卤化物或无机酸等,可制备S[44]、N[45]和卤素等非金属离子以及SO42- [48]。等酸根离子修饰的TiO2光催化剂;在Sol-Gel母液中添加金属盐,再经超临界处理,可制备La2O3等金属氧化物[47]以及其他半导体化合物(如CdS)修饰的TiO2光催化剂;最近还在超临界条件下制备了由La2O3和B共修饰以及N和F共修饰的TiO2光催化剂[48-49]。所有这些材料的制备均以采用乙醇为超临界流体,因为若采用CO2介质时,获得的光催化剂均呈无定型。研究表明,在乙醇介质中进行超临界处理,获得的TiO2系列光催化剂,一方面具有高锐钛矿结晶度和热稳定性(如图7-2所示)[44];
|
|
|
图7-2直接加热法(DC)和超临界干燥法(SC)制备的TiO2和TiO2-XSX
样品经673K焙烧后的XRD图.插图为TiO2-XSX(SC)样品在不同温度焙烧后的XRD图。 (a) Ti02(DC);(b)Ti02(SC);(c)
TiO2-XSX(SC) |
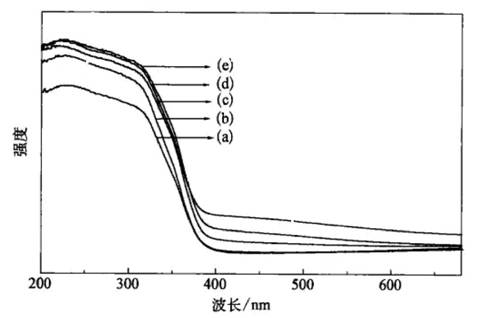
另一方面,修饰剂与TiO2作用力增强,不仅修饰剂的分散度增加,分布更加均匀,而且易进入TiO2晶格,由此形成中间能级。导致光吸收“红移”(如图7-3所示)[44]。
|
|
|
圈7-3直接加热法(DC)和超临界干燥法(SC)制备的TiO2和TiO2-XSX 样品的紫外-可见漫反射光谱图 (a)Ti02(DC),(b)Ti02(SC);(c)1.4%TiO2-XSX; (d)1.8
TiO2-XSX;(e)2.6%TiO2-XSX |
在可见光照射下就可以进行光催化反应;同时,超临界条件下进行的掺杂修饰能够诱导产生更多的Lewis酸位、表面氧空位或晶体缺陷,有利于捕获光生电子而抑制其与空穴的复合,提高光催化量子效率;另外超临界处理可提高比表面积和增加孔容积,增加了对光的吸收和对反应物的吸附。这些因素均有利于提高光催化活性(如表7-1所示)[44]。[101]
表7-l 不同样品的结构参数和光催化活性*
|
样品 |
[CS2]/(mol/L) |
SBET/m2/g |
Vp(cm3/g) |
Dp/nm |
Band
gap/eV |
Degradation/% |
|
TiO2 (DC) |
0 |
21 |
0.031 |
5.7 |
3.2 |
7.0 |
|
TiO2 (SC) |
0 |
68 |
0.37 |
20 |
3.2 |
11.2 |
|
P25
TiO2 |
0 |
45 |
0.25 |
20 |
3.1 |
10.0 |
|
0.50
TiO2-XSX |
0.68 |
88 |
0.38 |
23 |
2.8 |
74.5 |
|
1.0
TiO2-XSX |
1.4 |
91 |
0.38 |
23 |
2.7 |
78.0 |
|
1.4
TiO2-XSX |
2.0 |
97 |
0.40 |
24 |
2.7 |
83.3 |
|
1.8
TiO2-XSX |
2.7 |
104 |
0.42 |
25 |
2.6 |
88.6 |
|
2.6
TiO2-XSX(SC) |
3.4 |
97 |
0.43 |
27 |
2.7 |
82.7 |
|
1.7
TiO2-XSX(SC) |
/ |
90 |
0.59 |
17 |
2.90 |
64.5 |
[102]*反应条件; 0.050 g光催化剂,50mL O.010 g/L甲基兰水溶液,三只150 W氙灯(λ>420 nm)·反应温度303 K,反应时间3 h。
3.2 醇解Sol-Gel法应用于光催化剂的制备
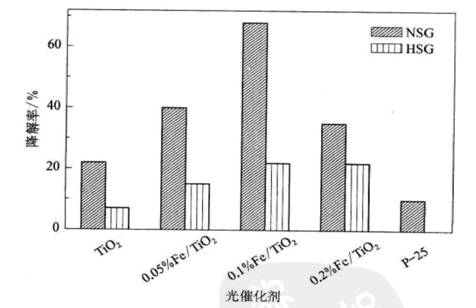
传统Sol-Gel法的基本步骤是水解-聚合。由于水解速率难以控制,所制备的TiO2系样品均为无定型,为提高结晶度,需要高温处理,容易发生团聚和孔道塌陷,导致比表面积下降,而且需要采用金属醇盐作为钛源,因此光催化剂的生产成本较高[28-31]。醇解比水解反应温和,有利于控制Ti-O-Ti的形成速率[50-52],能够在低温下获得较高结晶度以及规整孔结构。以TiCl4为钛源,苯甲醇诱导醇解-聚合,可获得具有高结晶度的TiO2纳米晶,即使未经焙烧,催化活性巳接近P25[53-54]。在Sol-Gel母液中加人少量Fe(NO3)3,采用叔丁醇为醇解剂.可获得Fe(Ⅲ)修饰的TiO2光催化剂(Fe/ TiO2)[53],Fe(Ⅲ)修饰剂大多数进入TiO2骨架,导致吸收光“红移”,在可见区呈现较强吸收,同时由于叔丁醇的结构导向作用,催化剂呈现典型的介孔结构特征,比表面积可达130 m2/g左右。该催化剂应用于可见光(波长超过420 nm)照射下的甲基兰降解反应,活性远远高于P25,同时也高于非修饰的TiO2以及采用传统水解Sol-Gel法制备的Fe/TiO2,如图7-4所示。
|
|
|
图7-4醇解(NSC)和水解(HSG)Sol-Gel法制备TiO2和Fe/TiO2
样品光催化活性比较 (反应条件:O.050
g光催化剂.50 mL 10 mg/L甲基蓝溶液.三只150 w氙灯λ>420 nm,反应温度303 K.反应时问3 h) |
[103]一方面,催化剂的介孔结构和大比表面积有利于有机反应物的扩散和吸附;一方面高锐钛矿结晶度有利于光生电子和空穴的分离,抑制其复合;更为重要的是,醇解法能够显著增强Fe(Ⅲ)和TiO2的相互作用,提高了Fe(Ⅲ)的修饰效果,因此在同等条件下,采用醇解法代替水解法,Fe(Ⅲ)修饰对光催化活性的促进作用大大加强。将醇解与溶剂热法相结合,可以合成多级结构的TiO2光催化剂[56]。如图7-5所示,
|
|
|
图7-5
醇解-溶剂热法制备的不同醇热时间的TiO2样品的SEM和TEM形貌 |
|
(a)1/24天;(b)0.5天;(c)l天;(d)2天;(e)7天;(f)14天 |
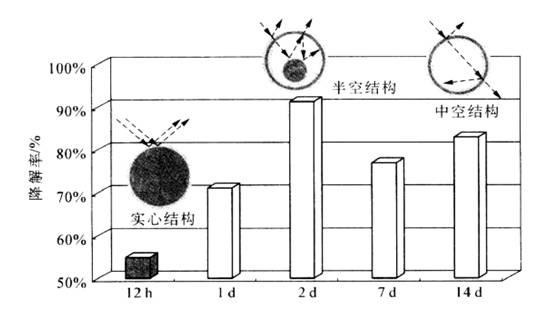
随着溶剂热处理时间的改变,TiO2由实心颗粒转化为核壳结构,最后叉成为空壳结构。可能的原因是在溶剂热条件下,既发生醇解反应,又发生醇脱水,由此进一步诱导水解反应,导致球壳生长,内核逐渐减小并最终消失.形成多级结构。在光催化降解苯酚反应中,具有核壳结构的TiO2比实心结构和空壳结构的TiO2活性显著提高.主要归因于核壳存在下,光发生重复反射,提高了光的利用率,如图7-6所示。
|
|
|
图7-6不同结构TiO2样品的光催化活性比较 |
|
(反应条件:0.050 g光催化剂.150 mL 1.O mmol/L苯酚溶液, 四只8 w紫外灯λ=365 nm.反应温度303 K,反应时间4 h) |
3.3 溶剂蒸发诱导表面活性剂自组装(EISA)用于光催化剂的制备
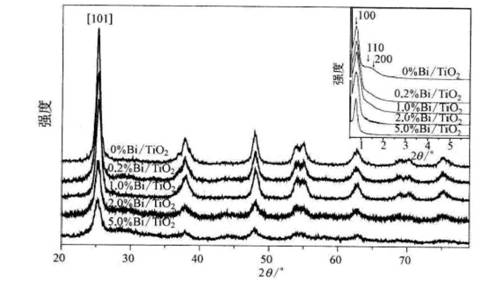
自1994年Mobil公司成功开发有序介孔硅材料以来,有序介孔材料成为当前材料领域的(104)研究热点,但目前所报道的有序介孔氧化硅均呈现无定型态[57-58]。对于TiO2光催化剂,有序介孔结构有利于提高比表面积和反应物的扩散以及在孔道内表面的吸附,但同时要求具有高结晶度,有利于光生电子和空穴的分离,减少其复合。但晶化过程会破坏孔道结构,导致有序度下降,因而在介孔结构的有序性和TiO2的结晶度问题上两者是一对矛盾。1998年,Yang等[59]首次报道了用EISA的方法合成有序介孔TiO2。Arahatzis等报道通过TiO2负载纳米金,可显著提高光催化活性[60]。我们以TiCl4和Ti(OBu)4为混合钛源,通过添加Bi(NO3)3,由EISA法原位合成了Bi2O3/TiO2,图7-7显示,
|
|
|
图7-7
EISA制备的不同Bi/Ti物质的量比的Bi/Ti02样品的广角和小角XRD图谱 |
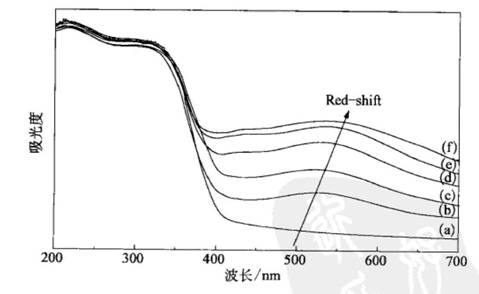
该材料具有有序介孔结构,而且孔壁由高结晶度的锐钛矿构成。作为可见光催化剂,其催化活性远远高于由传统Sol-Gel法原位合成的Bi203/TiO2[61]。如果采用AuCl3为修饰剂,则可合成具有高锐钛矿结晶度的有序介孔Au/TiO2 [62],平均孔径6 nm左右。XPS显示,Au以金属态存在,当Au修饰量低于O.50%时,Au颗粒均匀镶嵌于孔壁中,进一步增加Au修饰量,由于Au颗粒增大,其直径超过孔壁厚度,可在孔道内观察到Au颗粒。由于Au纳米粒子的Plasmon效应,Au/TiO2在可见区(400~600
nm)呈现强吸收,如图7-8所示,
|
|
|
图7-8不同Au掺杂量(摩尔分数)Au/TiO2催化剂的紫外-可见漫反射光谱围 |
|
(a) TiO2;(b)O.1
Au;(c)0.5 Au;(d)1.0 Au;(e)2.0 Au;(f)5.O Au |
[105] 导致其光催化活性大幅度提高,而当Au修饰量过高时,光催化活性下降,主要是因为Au粒子过大时,Plasmon效应消失,同时孔道堵塞。导致光吸收以及光催化量子效率下降。采用高温EISA法,还可合成具有泡沫结构的TiO2。如图7-9所示,
|
|
|
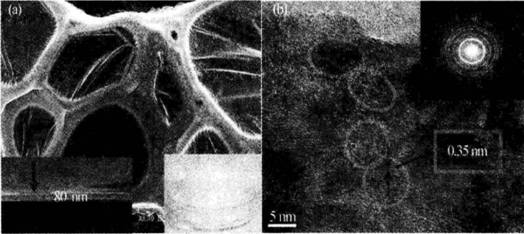
图7-9泡沫状TiO2样品的形貌图((b)中插图为SAED图) |
|
(a)SEM;(b)TEM |
样品由骨架和薄膜两部分构成,薄膜厚度在80 nm左右,具有纳米介孔结构,平均孔径在4 nm,薄膜具有较高的机械稳定性,可根据光催化反应器的需要设计成不同形状。TEM清晰显示锐钛矿相的晶格,表明具有很高的结晶度,在气固相光催化降解有机污染物时显示高活性,约为P25的5倍,除具有介孔结构和大比表面积以及高锐钛矿结晶度外,TiO2薄膜的高透光率能够有效克服传统光催化剂内层无光照的缺陷。因此光催化剂的活性得到充分发挥。
3.4 喷雾干燥技术应用于光催化剂的制备
喷雾干燥法辅助表面活性剂自组装在TiO2材料合成中得到了广泛应用[63-64],其特点是集自组装、水解、交联聚合、干燥成型以及去除模板剂为一体,具有快速高效的特点,适合于制备均匀粒径和不同孔道结构的新型材料。采用TiCl4和正硅酸乙酯(TEOS)的乙醇溶液为雾化液,经喷雾干燥处理获得SiO2-TiO2复合材料,由HF溶液处理,此时样品发生重组和结晶,获得具有单晶结构的TiOF2,如图7-10所示[65]。与由F-掺杂获得的TiO2-XFX相比,TiOF2不仅在紫外区的吸光能力大幅度提高,而且在可见区产生较强吸收,因此TiOF2导带和价带的能隙较小,容易被可见光激活。将TiOF2应用于可见光(>420 nm)照射下的亚甲基兰光催化降解,其催化活性比TiO2-XFX高1倍左右,同时催化剂能够重复使用lO次以上而活性保持不变,其稳定性远远高于TiO2-XFX。除光吸收强外,TiOF2的单晶结构有利于光生电子由本体迅速向表面扩散,减少其与空穴的复合.有利于提高光催化量子效率。采用喷雾干燥技术还可制备其他多种钛系列和非钛光催化剂,如我们通过喷雾干燥辅助表面活性剂合成出的内部包含纳米小球的Bi2Ti2O7微球[66]是一种优良的可见光催化剂。该催化剂的活性明显高于P25 TiO2和化学沉淀法制备的Bi2Ti2O7,这是由于喷雾干燥技术制备的Bi2Ti2O7结晶度高且无相转移,孔结构所形成的比表面积大,以及较窄的禁带宽度(2.9 eV)有利于可见光的吸收。
4 光催化性能检测与评价
[106]
4.1 光催化性能测试
由于污水中有机污染物种类繁多,成分各不相同。大多难以直接被微生物降解或光降解,光催化可将多种污染物完全矿化为无毒的二氧化碳、水和其他的无机小分子,是一种环境友好的有效处理新技术。目前在评价光催化剂的催化活性的研究中,很多研究者选择在化工行业和印染行业废水中具有代表性的且较难分解的酚类化合物如苯酚、对氯苯酚等以及有机染料作为光催化降解反应的目标反应物。反应物降解程度可采用UV分光光度计测定吸光度,根据吸光度与反应物浓度的线性关系计算降解率,考察催化剂的光催化降解性能。同时还有必要进行总有机碳含量(TOC)的测定,分析有机物完全矿化的程度,以确定污染物是否完全转化为二氧化碳和水还是转变为其他的有毒中间体。光催化剂的使用寿命评价亦是性能测试的重要内容,通过多次的套用实验以探索催化剂的失活机理,包括中毒机制、活性组分流失性能以及水热稳定性等.并据此提出相应的催化剂再生和回收方法。
光催化性能测试过程中,诸多因素会对光催化反应效率产生影响[3]。
1)光源和光强
由于TiO2表面杂质和缺陷的影响,其在较大的波长范围内均有光响应,一般为250~400 nm,可使用高压、中压、低压汞灯以及紫外灯、杀菌灯等。光催化反应速率一般与光强的平方根存在线性关系,但由于存在中间氧化物在催化剂表面的竞争型复合,并非光强越大光催化反应速率越高.光强过大时(>6×lO-5Einstein/(L·s)),光催化没有效果。
2)有机物浓度
光催化氧化的反应速率(r)可应用Langmuir-Hinshelwood动力学方程式描述如下:
|
r= |
kKc |
|
1+Kc |
式中:k —— 发生于光催化剂表面活性位上的表面反应速率常数;
K —— 表观吸附平衡常数;
C —— 反应物浓度。
低浓度时,Kc<<1,反应速率与溶质浓度成正比。初始浓度越高,降解速率越大,但在高浓度范围,反应速率与溶质浓度无关。
3)反应温度
由于光催化反应的表观活化能很低。其反应速率对温度的依赖性不大。特别是在光强较高的情况下,反应速率还有可能随温度的升高而降低,这是由于·OH的双分子复合生成H2O2
4.2 光催化剂结构与性能的关系
通过探索不同的合成方法可以调节光催化剂的微观结构、形貌以提高催化剂性能。影响TiO2光催化剂催化性能的结构因素主要有以下几个方面。
1)晶体结构
常用的二氧化钛半导体光催化剂的二氧化钛有锐钛矿型(anatase)和金红石型(rutile)。由于两者的单位晶胞的八面体畸变的程度和八面体之间的相互联接的方式并不相同(如图7-11所示),这样就使得与金红石型二氧化钛(禁带宽度为3.O eV)相比,锐钛型二氧化钛(禁带宽度为3.2eV)可以产生更多的表面活性中心,因此光催化活性更高[88]。通过溶胶-凝胶结合超临界流体萃取法合成的TiO2是锐钛矿型二氧化钛催化剂,即使在高温焙烧条件下也不会转型。[108]
[233]
5 光催化剂应用
在半导体金属硫化物中有相应的金属离子、硫离子和许多空位,可作多种催化反应的催化中心。S2-的电负性比O2-小,金属-硫键更具共价性,表面硫比表面氧更活泼。Co、Ni、Fe、Mo和W等硫化物催化剂具有加氢、异构化、氢解、脱硫、脱氮等多种催化性能。在加氢脱硫催化反应中,反应气体H2先在金属硫化物表面吸附,解离为H+,金属离子还原为低价态离子, H+再与附近的无机硫离子作用生成H2S气体,在H2S气体析出同时产生金属硫化物中硫空位,硫空位与重油中苯并噻吩、二苯并噻吩、呋喃、吡啶等分子中的硫作用,恢复金属硫化物,完成脱硫催化循环:
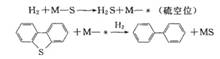
Mo与W硫化物脱硫效果最好,Fe、Co、Ni为助剂。
金属氧化物和硫化物半导体还是光催化剂,半导体光催化氧化已应用于去除水中有机物。
5.1 半导体光催化[4-14]
金属氧化物或硫化物半导体,如TiO2、CdS、ZnO、ZnS、WO3、Fe2O3等在紫外光照射下,吸收一定能量的光量子后,其满带中电子很易受激发.跃迁到空带成为导电电子,空带成为导带,而此时满带因失去电子形成带正电的空穴(h+),这样在半导体表面形成电子-空穴对,其中的空穴有很强的氧化势,它除了能直接起氧化作用以外,主要通过与周围有机物、水、羟基发生电子转移,夺取它们的电子。其中羟基失去电子后生成有很强氧化性的羟基自由基·OH,该羟基自由基几乎能氧化水体中所有有机物,使其最终变成CO2和水。从而消除了水体中有机物的污染。
5.2 TiO2光催化剂
以半导体TiO2为例:

TiO2固体表面担载高活性的贵金属或金属氧化物,如Au、Pt、Pd、Fe2O3、ZnO、WO3等,能够协助消除导带中处于激发态的电子,可有效防止电子-空穴的简单复合,提高半导体光催化降解有机物的性能。利用氙灯、高压汞灯为紫外光源,用TiO2半导体粉末催化剂,对大量有机物进行光催化氧化降解试验,如苯、苯酚、一氯苯、硝基苯、苯胺、邻苯二酚、苯甲酸、间苯二酚、对苯二酚、l,2-二氯苯、2-氯苯酚、3-氯苯酚、4-氯苯酚、2,4-二氯苯酚、2,4,6-三氯苯酚、2-萘酚、三氯甲烷、三氯乙烯、亚乙基二胺、二氯乙烷、水杨酸、苯二甲酸、甲醇、乙醇、丙醇、2-丙醇、丙酮、乙酸乙酯、乙酸、甲酸、蔗糖、伞形酮等,降解都非常彻底。到目前为止已研究了100余种有机化合物光催化降解,表5.5列举了一些半导体催化剂对有机物光降解情况。
[234]
表5.5 半导体催化剂光降解不同类型有机物
|
有机物类别 |
有机物名称 |
催化剂 |
光源 |
光催化降解产物 |
|
烃 |
脂肪烃 芳香烃 |
TiO2 |
紫外光 |
CO2、H2 |
|
卤化物 |
氯化烷烃 氯化烯烃 卤代脂肪酸 卤代芳香化合物 CDD、DCDD、DCB |
TiO2 Fe2O3 TiO2 ZnO、CdS Pt/ TiO2 |
紫外光 |
HCl、CO2 |
|
羧酸 |
乙酸、丙酸、丁酸 戊酸、乳酸 乙酰丙酸 |
Sr
TiO2 TiO2 CdS、ZnO |
紫外氙灯 |
CO、H2、烷烃、醇酮、酸 |
|
表面活性剂 |
DBS SDS BS 4-苯酚 |
TiO2 |
日光灯 |
HCl、CO2、SO42- |
|
染料 |
酸性红G 直接耐酸大红4BS 活性艳红X-3B 酸性艳蓝G 卡普隆5GS 阳离子艳红5GN 直接耐晒翠蓝RGL |
TiO2 |
紫外光 |
CO2、H2O、无机离子、中间产物 |
|
含氮有机物 |
磷酸四丁基铵 乙二胺四乙酸钠 阿特拉津 氟尿嘧啶 环磷酰胺 2,4-二硝基苯酚 4-硝基邻苯二酚 青雷胺 硫得达嗪 地昔帕明 苯丙氨酸 |
TiO2 |
紫外光 |
CO32-、NO3-、NH4+、PO43-、F-、Cl-、SO42- |
|
有机磷杀虫剂 |
DDVP DEP |
TiO2 |
紫外光、太阳光 |
Cl-、PO43-、CO2 |
影响光催化氧化效果的因素有光源特性、有机物性质和浓度、操作条件、溶液pH、溶液含氧量、金属离子尤其是高价离子共存情况、温度等。表5.6为不同波长的光能,波长越短,光能越高,光降解效能越高。表5.7为常见化合物的键能,键能越小,越容易破坏,最易降解的是C-S和C-N键,最难降解的为C-F键,其次是O-H键。表5.8为常见紫外光源特性,金属卤化物灯波长最短,光能最高,而且功率与波长可调,适合于研究工作。研究表明半导体催化剂粒径与光催化活性相关,对于TiO2来说粒径30nm左右效果最好,而且锐钛型TiO2活性高于金红石型。
表5.6 不同波长的光能
|
波长/nm |
150 |
200 |
300 |
420 |
470 |
530 |
580 |
620 |
700 |
|
光能/KJ/mol |
796.7 |
597.3 |
398.4 |
284.7 |
254.1 |
225.3 |
206.1 |
192.7 |
170.5 |
[235]
表5.7 常见化学键键能
|
化学健 |
C-F |
O-H |
C-H |
C-O |
N-H |
C-C |
C-Cl |
C-N |
C-S |
|
键能/kJ/mol |
497.4 |
462.3 |
413.0 |
363.7 |
351.1 |
346.9 |
328.1 |
284.2 |
275.9 |
表5.8 常见紫外线光源特性
|
光源种类 |
主波长/nm |
平均寿命/h |
特点 |
|
低压汞灯 |
253.7 |
700~2000 |
功率≤1000W |
|
中压汞灯 |
365~可见光 |
2500~5000 |
功率几十瓦至上万瓦 |
|
高压汞灯 |
|||
|
氙灯 |
>700 |
1000左右 |
光学特性搂近太阳 |
|
金属卤化物灯 |
200~400 |
>2000 |
紫外线强大,功卑波长可调 |
5.3 其他半导体光催化剂
CdS是一种直接带隙的ⅡB族半导体材料,有闪锌矿结构和纤锌矿结构两种同位素异构体,它们的带隙分别为2.4eV和2.47eV,带隙能量很低,满带中电子很易激发跃迁入空带形成导带,可在可见光照射下进行光催化氧化。但由于镉易造成环境毒害作用、因此安全性不如TiO2。TiO2作为光催化材料,具有价廉、无毒害作用、使用周期长、稳定性好、催化活性高等优点,因此是常用的一种光催化半导体材料。TiO2半导体主要缺点是禁带宽,在可见光下光催化活性低。为了提高对日光的利用率,许多研究者研究了在TiO2粒子表面担载活性金属和金属氧化物,如Ag、Pt、Pd、Rh,Nb、Ru02、Pt-Ru02、SiO2、ZrO2、α-Fe203,β-FeOOH,改善半导体的能级结构,降低带隙能,使吸收光波长向可见光区拓展,提高光催化效能。例如Fe2O3/TiO2摩尔比为0.5%左右具有最佳催化效果。在TiO2粒子中加入光敏剂,如蒽醌、腐植质、金属酞菁及卟啉类化合物等,扩展半导体光响应范围,也可以提高对日光能利用率。同时,研究新型可见光催化剂:如钙钛矿型光催化材料:Cr3+-SrTiO3型光催化材料、Sb-Sr-TiO3光催化材料、La-Sr+FeO3光催化材料等ABO3型材料;ABO4型可见光催化剂,如InVO4、InNbO4、InTaO4,其禁带能宽度分别为1.9eV、2.5eV、2.6eV,都可在可见光下使用,使水分解得到H2。BiMO4(M为Nb和Ta)化合物的禁带能宽度为2.4~2.7eV,它们都能在近紫外光和可见光激发下分解水生成H2和02。BaCrO4和SrCrO4的禁带能宽度分别为2.63eV和2.44eV,在紫外和可见光照射下,可以分解甲醇,产生氢气,其中BaCrO4活性高于SrCrO4。AB02型光催化剂是近年来受到关注的新型光催化剂,具备良好的可见光催化性能。如CuFeO2能在可见光照射下,分解水生成H2和O2,寿命可达1800h。NaInO2能在可见光照射下催化分解水产生H2和O2。
杂多酸如钼酸盐和锑酸盐等也是一类可见光催化剂,研究表明,它们能高效氧化分解有机污染物为CO2和简单的无机物,在近可见光和紫外光照射下其光催化氧化活性几乎和TiO2一样高。杂钨酸H3PWl2O40在紫外光-可见光激发下,能在室温下将全氟代聚丙烯酸酯分解为F-和CO2,且不会产生CF4、CF3H等有害物质。将杂钨酸压缩到钛金属交换的Hy沸石中后(TiHy)可用于光还原甲基橙,光催化速率比单独沸石快20倍。太阳能光催化技术仍处于实验阶段,是亟待进一步深入研究开发的课题[10]。
[236]
6 Fenton试剂催化
6.1 Fe2+/H202体系
Fenton试剂催化是指亚铁离子与双氧水反应产生羟基自由基·OH,羟基自由基具有极强的氧化性,已用于废水处理。该法是前苏联学者在20世纪70年代提出来的一种目由基引发的均相催化。其一般反应历程如下。
引发: Fe2++H2O2→Fe3++·OH+0H-
链增长: ·OH+H2O2→H2O+HO2·
HO2·+H2O2→O2+H2O+·OH
链终止: ·OH+Fe2+→Fe3++OH-
羟基自由基对有机物氧化反应:
·OH+RH—R·+H2O
R·+H2O2→ROH+·OH
Fe2++·OH→OH-+Fe3+
其中ROH继续与·OH反应,可以最终碳化,生成CO2和H2O。
Fenton试剂催化效能与Fe2+/H2O2比例、有机物浓度、pH、反应时间、反应温度、共存杂质等有关。最佳pH≤3,此时生成的三价铁主要以Fe(OH)2+羟基配离子存在,它既是一种光敏剂,促进产生羟基自由基;同时又对废水中荷负电的悬浮体起电中和作用,并具有混凝效果,促进催化氧化废水中有机物进程。已用Fenton试剂氧化处理含硝基苯、苯甲酸、苯胺、酚、甲酚、氯酚、二氯酚、二硝基酚、农药、染料等废水,COD去除率达90%,平均脱色率97%以上。
6.2 Ti3+/H2O2体系
除了亚铁离子与双氧水反应能产生羟基自由基以外,其他在d轨道含未成对电子的过渡金属离子都能发生类似反应。如Ti3+:
Ti3++H2O2→Ti4++·OH+OH-
Ti3++·OH→Ti4++OH-
·OH+H2O2→H2O+HO2·
HO2·+H2O2→O2+H2O+·OH
·OH+Ti3+→Ti4++OH-
其他有两种价态的离子也都有类似反应,因此可写成通式:
Mn++H2O2→M(n+1)++·OH+OH-
Mn++·OH→M(n+1)++OH-
·OH+H2O2→H2O+HO2·
HO2·+H2O2→O2+H2O+·OH
·OH+Mn+→M(n+1)++OH-
生成的羟基自由基具有极强的氧化性,其还原电势达2.80eV,电子亲和能达569.3kJ·mol-1,几乎可以氧化降解所有有机物。
6.3 UV/Fenton催化
Fenton试剂法与紫外光照相结合发展了UV(紫外线)/Fenton催化:
[237]
Fe2++2H2O2+hv→Fe3++3·OH+OH-
Fe3++OH-→Fe(OH)2+
Fe(OH)2++hv→Fe2++·OH
H2O2+hv→2·OH
由此可见,由于UV的参与,加速羟基自由基产生,极大促进了光催化降解效能。 电Fenton是由铁阳极通过电解作用产生羟基自由基,极大促进了光催化降解效能。H202反应产生羟基自由基,其优点是不用外加亚铁盐,直接由电解产生,降低了成本,使用更加方便。也可以电解产生H202,与亚铁离子产生羟基自由基。
6.4 O3/H2O2催化
引发产生羟基自由基的体系还有:O3/H2O2、UV/H2O2、UV/O3等,都已用于废水处理。其中,
O3/H2O2引发羟基自由基反应如下。
引发: O3+OH-→HO2-+O2
H2O2→OH2-+H+
O3+HO2-→·OH+O2-+O2
链增长:
O3+O2-→O3-+O2
O3-+H+→·OH+O2
HO2-+·OH→HO2·+0H-
H2O2+·OH→HO2·+H2O
该体系中氧化有机物的除羟基自由基以外,还有03和02,因此对有机物的降解速度比单纯03或H202显著加快。
6.5 UV/H2O2催化
引发的羟基自由基反应如下。
引发:
H2O2+hv→2·OH
无紫外光照射时: 2H2O2→O2+H2O
链增长:
·OH+H2O2→H2O+HO2·
HO2·+ H2O2→H20+O2+·OH
链中止:
2·OH→H2O2
20世纪70年代以来,已用此法降解处理废水中腐蚀酸、氯仿等有机物,产物为CO2和H2O,不会产生二次污染。
6.6 UV/O3催化
UV/O3引发羟基自由基反应为:
O 3+hv→O 2+ O·(游离氧)
O·+H2O→·OH+OH-
另一种机理为先生成H202,然后H202在光诱导下产生·OH:
1/3 O3+H2O+hv→H2O2