棉纤维伴生物和棉纺织品的酶精练yd14114
邵行洲 上海纺织科学研究院(退休)
杨栋樑 全国染整新技术应用推广协作网
原载:全国染整新技术协作网简讯2011年8/10/12
在棉纺织品染整加工中,退浆、精练和漂白等前处理工序是影响印染成品质量的关键工序。据称;印染成品疵病中有80%是由不良的前处理造成的。在传统的前处理工艺中,强碱、强酸、氧化剂等化学药剂,在高温和长时间的剧烈加工条件下,对棉纤维可能会造成很大损伤,并耗用大量的水和能源,其排放的废水染污程度严重(平均COD约为3000~3500mg/L),数量约占染整加工总排放量的60%(或以上),这些已成为目前染整工业持续发展的重要障碍。用针对性的生物酶制剂进行纺织品的前处理,是目前大家所关注的高效、低耗、清洁绿色加工,更是今后染整工业的一个重要发展方向。本文是我们将阅读有关资料的摘录整理成文的;在阅读过程中,深感生物化学和生物分子学这门学科的深奥和资料浩如烟海,也倍感自己知识的贫乏。本文可能挂一漏万旨在“抛沙引钻”,期待读者的批评补充和指正,更期待酶制剂化学家和染整工作者能对此有更大的关注和紧密合作,开创出一个崭新的高科技的绿色染整工业,造福于人类。
一、棉纤维的结构和组成
(一)棉纤维的生长过程
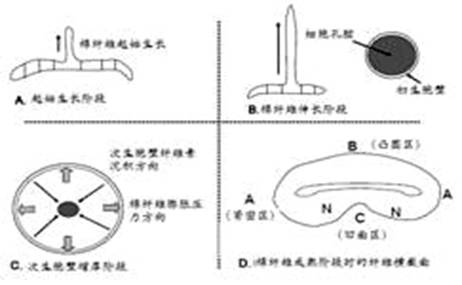
棉纤维生长分四个阶段,如图1所示:
(1)起始生长阶段(图1中的A),棉株开花后2天,棉纤维起始生长,棉籽的外表皮突起, 形成管束状棉纤维单细胞。
(2)棉纤维伸长阶段(图1中的B),在20-25天中,突起的管束状棉纤维细胞表层(外表层和初生胞壁)不断地纵向伸长,形成最后棉纤维的长度。
(3)次生胞壁增厚阶段(图1中的C),在开花后的35到50天时期内,纤维素大分子不断地由细胞表层向中心沉积,形成次生胞壁,并使棉纤维细胞胞壁膨胀扩大。此时,由于棉纤维细胞表层(外表层和初生胞壁)有相当强度和柔(韧)性,承受膨胀扩大的压力,为次生胞壁增厚提供空间。
(4)成熟阶段(图1中的D),前面三个阶段都是在封闭的管束中进行的。在完成次生胞壁增厚阶段后,园形的管束壁破裂,内部水分蒸发,由于次生胞壁内纤维素密度不同,成熟干燥过程中,棉纤维的园形截面逐渐被挤压成“肾脏“形,形成图中的A(紧密区)、B(凸圆区)、C(凹面区)和N(中性区)四个区,它们的可及性(Accessibility)顺序是N > C > B > A。
|
|
|
图1 棉纤维生长过程示意 |
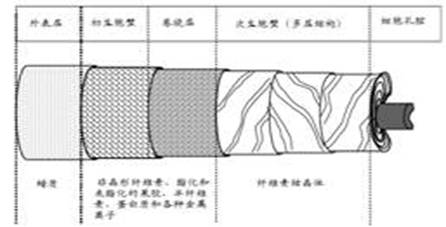
(二)棉纤维的结构和伴生物组成
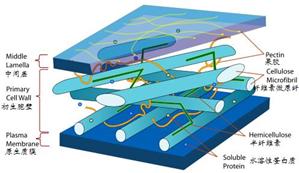
棉纤维是多层同心园的单细胞组织,有外表层、初生胞壁、卷绕层、次生胞壁和细胞孔腔组成。如下图。
|
|
|
图2 棉纤维的结构 |
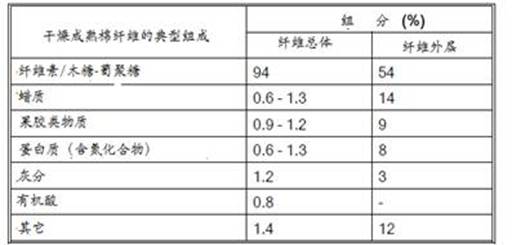
在成熟棉纤维的化学组成中,除了90%以上是纤维素外,还有相当量的果胶质、油蜡、半纤维素和含氮物质等伴生物。如表1所示
表1 棉纤维的化学组成
|
|
|
|
(三)棉纤维的外表层(cuticle)
棉纤维的外表层是由一些疏水性的软木脂和角质素等生物聚酯类组成的表面光滑的薄膜,其厚度只有12 nm,但结构紧密,是植物生长过程中,防御自然环境(温度、水分流失和虫害等)对其伤害的生长保护层。人们习惯把棉纤维的这些脂类物质称为棉蜡(cotton waxes),“棉蜡”熔点很高,范围也很广(64°C - 214°C),组成很复杂,其含量是棉纤维干重的0.4 -0.8%,它是水和其他小分子向纤维内扩散(也是染整加工)的第一道屏障。
软木脂(suberin)主要是一些C16 和 C18的化合物,呈中等疏水性,内部沉积着更疏水的蜡质。在棉(green cotton)的次生胞壁中有多达20个由这类软木脂把纤维素分隔的同心层。
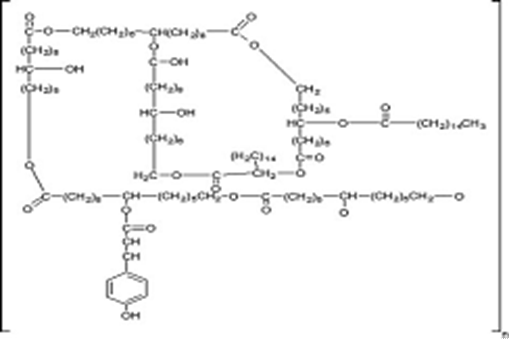
角质素(cutin)是一些C16 和 C18含有羟基和环氧基的高级脂肪酸,通过相互酯化生成的疏水性聚酯类物质,其结构通式如(1)式所示。按其C16 和 C18单体可分两类:一类单体是16-羟基棕榈酸和9,6-或10,6-二羟基棕榈酸;另一类的单体为18-羟基油酸和9,10-环氧基-18-羟基硬脂酸和9,10,18-三羟基硬脂酸盐。
|
|
|
(1) |
棉纤维外表层的组分如表2所示:
表2 棉纤维外表层的详细组分
|
类别 |
主要组分 |
干重% |
外表层中详细组分 |
||||
|
组分 |
分子式 |
分子量 |
熔点(℃) |
备注 |
|||
|
不可皂化部分 52-62% |
高级脂肪醇 C23toC34 |
40-52 |
正-三十醇 |
C30H61OH |
438.8 |
87 |
显著量 |
|
棉籽酚(有色物质) |
C30H30O8 |
518.5 |
184-214 |
显著量 |
|||
|
褐煤醇(1-二十九烷醇) |
C28H58O |
410.8 |
83 |
显著量 |
|||
|
二十九烷醇 |
C28H58O |
410.7 |
83 |
痕量 |
|||
|
其他醇 |
C28-C30 |
- |
- |
- |
|||
|
甘油(低级醇与脂肪酸生成的酯) |
|||||||
|
饱和及不饱 和脂肪烃 |
7-13 |
二十七(碳)烷 |
C27H56 |
|
|
|
|
|
三十(碳)烷 |
C30H60 |
|
|
|
|||
|
三十一(碳)烷 |
C31H64 |
|
|
|
|||
|
三十二(碳)烷 |
C32H66 |
|
|
|
|||
|
植物固醇 甾醇,固醇 糖苷,配糖物 和多萜烯类 |
3-8 |
β-谷甾醇 |
C20H50 |
414.7 |
|
|
|
|
γ-谷甾醇 |
C20H50 |
414.7 |
|
|
|||
|
谷甾醇 糖苷 |
C35H60O6 |
|
|
|
|||
|
α和β香树脂醇 |
C30H50O |
|
|
|
|||
|
可皂化部分37-47% |
(含偶数碳原 子的)游离脂 肪酸和其酯类 |
23-47 |
正二十四酸(木焦油酸) |
C21H43O20 |
368.6 |
84 |
显著量 |
|
正-十五酸 |
C15H30O2 |
242.0 |
69.6 |
痕量 |
|||
|
十六酸(棕榈酸) |
C16H32O2 |
256.4 |
64 |
显著量 |
|||
|
顺式-12-羟基十八碳烯-9-酸 |
C18H34O2 |
282.5 |
04 |
痕量 |
|||
|
十八酸(硬酯酸) |
C18H36O2 |
284.5 |
70 |
显著量 |
|||
|
异-二十二酸(山酸) |
C22H44O2 |
340.6 |
80 |
痕量 |
|||
|
正-十五酸 |
C15H30O2 |
242.0 |
69.4 |
痕量 |
|||
|
十六酸(棕榈酸)原文重复 |
C16H32O2 |
256.4 |
64 |
显著量 |
|||
|
|
树脂类 |
? |
有色树脂类物质 |
|
|
|
|
(四)棉纤维的初生胞壁及其组成
紧接着外表层内侧的是初生胞壁,其厚度大约为0.5 μm,是纤维素大分子可及性的第二个屏障。胞壁内主要是果胶、半纤维素和糖蛋白(又名伸展蛋白—extensin)等非纤维素类物质, 在初生胞壁中有少量无定形的纤维素微原纤,其纤维素分子聚合度Dp≤2000,比在次生胞壁的(Dp∽5000)低,且是无序地包埋在其它非纤维素类物质的基质中。
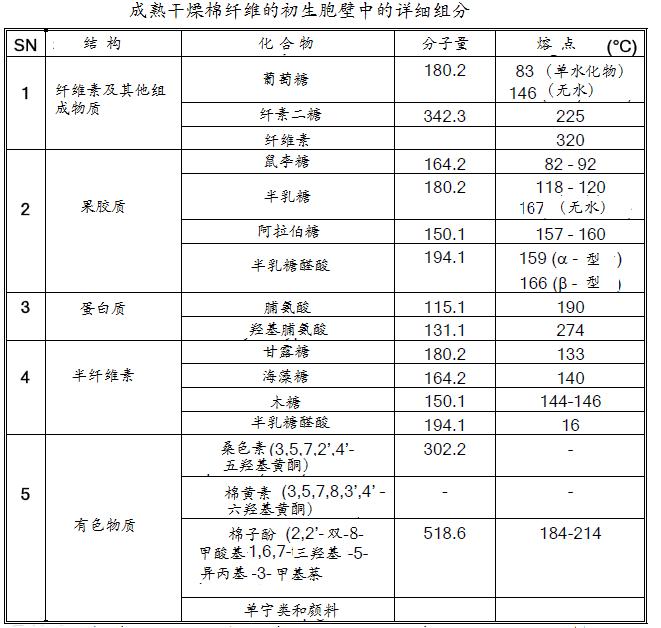
棉纤维初生胞壁的结构和详细组成,如图3和表3所示。
|
|
|
图3 棉纤维初生胞壁的结构示意 |
表3 成熟干燥棉纤维的初生胞壁中的详细组成
|
|
棉纤维初生胞壁中各组成的概况如下:
1)半纤维素是与纤维素伴生在细胞壁的一类杂聚多糖,由木糖、阿拉伯糖、甘露糖和半乳糖等几种不同类型的五碳糖和六碳糖构成的异糖多聚体,其中以木聚糖为主。它包复在纤维素微原纤(microfibril)的表面,并与果胶形成交联。
2)糖蛋白(又名伸展蛋白)在初生胞壁中约占15%,它是蛋白质主链上含有向外伸展的低聚糖侧链的杆状物,有人也称它为糖基化蛋白质,其中低聚糖要占65%。
3)果胶质(pectin)是一类植物性高分子杂聚多糖的总称,呈酸性,是棉纤维初生胞壁和卷绕层的的主要组分,在棉纤维生长过程中,它作为一种水合物(hydrate agent),控制着水等液体的流动,对最终棉纤维的纤度和结构有重要影响。
二、关于果胶质
(一)组成
果胶质的化学组成十分复杂。在化学结构上,果胶是果胶酸(pectic acid),化学名聚半乳糖醛酸(polygalacturonic acid),是未酯化的聚半乳糖醛酸(LM pectin),其分子中的羧基可以是游离酸,也可以是Na+、K+ 、Ca2+的羧酸盐)和果胶酸中大部分羧基酯化的聚半乳糖醛酸以α-1,4糖苷键结合而成的杂多糖(heteropolysaccharide)长链分子(HMpectin)。在自然界的果胶中,大约80%聚半乳糖醛酸的羧基被甲酯化。部分高酯化的果胶称为(pectinates);如其酯化度小于5%,则称之为果胶酸盐(pectates)。
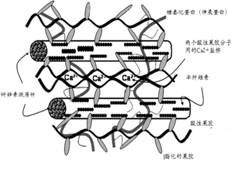
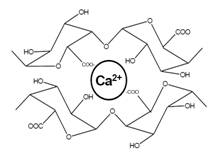
在棉纤维初生胞壁的非纤维素组分中,果胶是最重要和最复杂的。在初生胞壁的外层,主要是高甲酯化果胶(HMpectins),它作为一种凝聚剂,把其它非纤维素组分聚集在一起。初生胞壁中的果胶分子链中富有多糖低聚物侧链,而酯化果胶分子链中的侧链长度远比低酯化的果胶酸分子链中的大。这些果胶分子链上长的侧链能使细胞壁松弛,有利于纤维生长时细胞壁的扩张。酯化果胶不很稳定,在一定的湿度和温度下,酯基会脱离;在较低温度的碱性介质中,酯化果胶分子中的甲基也会很容易通过皂化反应而脱离。某些能降解果胶的裂解酶,其β-消除反应只发生在分子链中与甲基酯化残基相邻的苷键上,且果胶的甲酯化程度越高,消除反应的降解速率也越快。在卷绕层中,主要是未酯化或酯化度很低的果胶,这类亲水的酸性果胶分子链带有负电荷,对Ca2+等金属阳离子有很强的吸引力,从而使相邻的酸性果胶分子链间形成交联,使酸性的果胶大分子结合在一起,如图4所示。
|
|
|
|
图4 酸性果胶分子链间的交联示意图 |
|
为方便了解有关果胶类几个容易混淆的英文术语,现释义如下:
(1) Protopectin(原果胶):在完整的植物组织中不溶于水的果胶质,在有条件的水解下,原果胶生成果胶(Polymethyl galacturonate)或果胶酸(Pectic acid)。
(2) Pectic acid(果胶酸):是可溶性的半乳糖醛酸聚合物,它只含有可忽略量(negligible amount)-OCH3基团,其游离酸或酸性盐称为果胶酸盐(pectates)。
(3) Pectinic acids(果胶质酸;果胶酯酸):聚半乳糖醛酸分子链中含有>0和<75%甲酯化的聚半乳糖醛酸,这类酸的盐称为果胶酯酸盐(pectinates)
(4) Pectin(果胶Polymethyl galacturonate):半乳糖醛酸聚合物中≥75%的羧基被甲酯化。
(二)结构
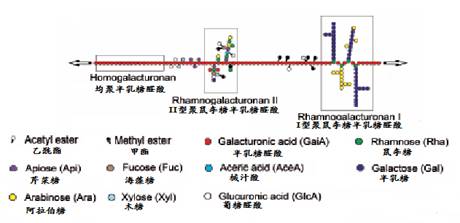
在果胶分子主链上还有鼠李糖、阿拉伯糖、半乳糖、木糖、海藻糖、芹菜糖等组成的侧链。经过分离和分析,有人把果胶大分子描述成三个结构域,即没有侧链均一的半乳糖醛酸聚糖 (Homogalacturonan 简称HG),称光滑区(smooth region)、有不同侧键组成的鼠李糖半乳糖醛酸聚糖I (Rhamnogalacturonan I-简称RGI)和鼠李糖半乳糖醛酸聚糖II( Rhamnogalacturonan II简称RGII)。在棉纤维的果胶大分子的主链中,60%的半乳糖醛酸残基是甲酯。它们的化学结构分别如图5所示:
|
|
|
图5 棉纤维的果胶大分子主链结构示意 |
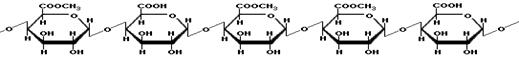
(1)同型半乳糖醛酸聚糖(HG)
HG是D-半乳糖醛酸以α-1,4糖苷键连接成线状的均聚多糖,其部分-COOH基被甲基和/或乙酰基酯化,其中未酯化的半乳糖醛酸部分也可能与钠、钾、钙形成盐。是大分子链的“平坦区域”。其结构如(2)式所示:
|
|
|
|
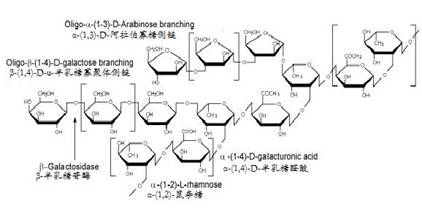
(2)鼠李糖半乳糖醛酸聚糖 I(RGI )
RG I是α-(1,4) 半乳糖醛酸和α-(1,2)鼠李糖组成的主链上有α-(1,3)-阿拉伯寡糖和β-(1,4)-半乳糖寡糖两个侧链,其结构如(3)式所示:
|
|
|
|
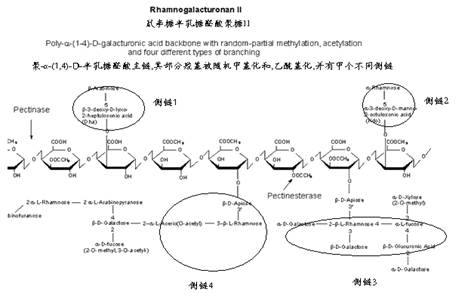
(3)鼠李糖半乳糖醛酸聚糖
II(RGII)
鼠李糖半乳糖醛酸聚糖 II
RGII是α-(1,4) 均聚半乳糖醛酸主链上有多达11种单糖组成的四个侧链.其结构如(4)式所示:
聚-α-(1,4)-D-半乳糖醛酸主链,其部分羧基被随机甲基化和乙酰基化,并有几个不同侧链
|
|
|
(4) |
三、棉织品酶精练剂的主要组分——角质酶和果胶酶
在了解棉纤维的结构组成后,印染工作者就可以策划在棉纺织品的酶精练过程中,选用哪些生物酶来去除棉纤维的外表层(cuticle)的蜡质和初生壁中的果胶等伴生物,以解除棉纤维外表层和初生胞壁对次生胞壁中纤维素大分子的这两个“屏障”,使纤维素分子链上的羟基暴露,有利于水等极性分子对其羟基溶剂化(亲水),使分子链内和分子链间的氢键断开,有利于水对纤维膨化,促进染料和有关助剂分子能在纤维内的“物流”,为后续的印花、染色和后整理工艺中,染料和各种化学药剂对纤维素大分子的良好接触创造基础。
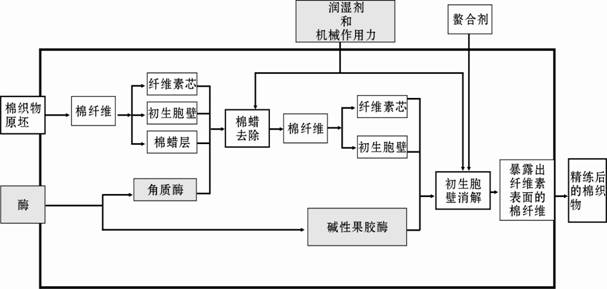
Agrawal等提出棉织物酶精练的加工路线,如图6所示:
|
|
|
图6 棉织物酶精练的加工路线 |
(一)角质酶(cutinase
EC 3.1.1.74)
在酶精练工艺设计中,首先要解除棉纤维可及性的第一道“屏障”—外表层。根据外表层的结构和组成,筛选能催化脂肪酸酯类水解反应的酶。在酶分类中,这类酶属水解酯酶(EC 3.1.1,X),其中可选用的有羧酸酯酶(carboxyl esterase EC 3.1.1.1)、脂肪酶(lipase EC 3.1.1.3) 和 角质酶(cutinase EC 3.1.1.74) 。在这三类酶中,羧酸酯酶对聚集较松散的脂肪酸酯有良好的酶促活性,但对聚集紧密的角质不理想。脂肪酶和角质酶对聚集紧密的角质都有高的酶促活性,但脂肪酶是非水溶性的,在酶促反应中,需要附加一个脂质和水界面的活化能,移去活性中心入口处的“盖”,才能使脂肪酶的活性中心与底物接触,发生酶促反应。而角质酶无此要求,同时在水解时它不需要Ca2+,这有利于它和果胶酶共用。由此可见,角质酶是较理想的去除棉纤维外表层的酶。
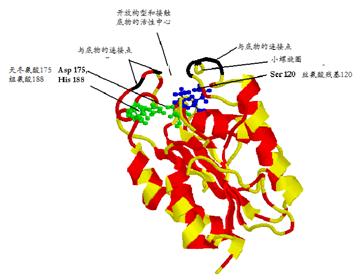
在自然界中,角质酶存在于一些植物病原体真菌和细菌中,如腐皮镰刀菌(Fusarium solani Pisi)和嗜热细菌(Thermobifida fusca)中。在结构上,角质酶(cutinase)是由典型的丝氨酸-组氨酸-天冬氨酸三单元(Ser, His, Asp triad)组成的水解酶,其特征是酶促活性中心是丝氨酸残基。其示意图如图7所示
|
|
|
图7 角质酶的结构示意图 |
(1)作用
角质酶是以角质(主要是高级脂肪酸酯)和水为底物,破坏植物外表皮中杂聚聚酯分子的酯键,使其水解为单体和小分子寡聚体。对于棉的精练而言,角质酶能催化棉纤维外表层中角质类高级脂肪酸酯的水解反应,破坏棉纤维外表皮中不溶性甘油三酯、可溶性酯和角质类等疏水性聚酯,解除掉了棉纤维可及性的第一道“屏障”,有利于精练时果胶酶对果胶的可及性,从而达到更良好的精练效果。所以Agrawal等人提出角质酶和果胶酶共用是解决单用果胶酶精练后棉织物润湿性不佳的主要策略。
2002年Degani 等人首次报导用反相高压液相色谱仪(reverse phaseHPLC)和气相色谱-质谱仪(GC-MS),跟踪测量角质物水解释放的C16和C18脂肪酸的方法,研究用假单胞菌属细菌(Pseudomonas mandocino)培养的角质酶处理棉织物,结果证实角质酶确对棉蜡的去除有酶促反应活性,但时间过长(10-20个小时),不能实际应用。
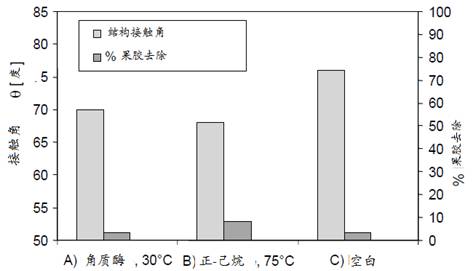
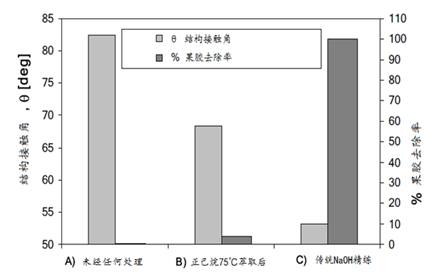
2007年Agrawal等人用腐皮镰刀菌(Fusarium solani pisi)生产的角质酶(100 U/g织物)在pH8的50 mM Tris-HCl(三羟甲基氨基甲烷-盐酸缓冲液)缓冲液中,30℃下搅拌处理15-30分钟,通过测定织物结构接触角*和扫描电子显微镜观察分析,结果表明该角质酶能有效的去除棉织物中的蜡质,其去除效果远远高于Degani所报道的,与正己烷处理的接近。
图8为棉织物用角质酶处理与用正-己烷萃取的织物结构接触角比较结果。
|
|
|
图8 棉织物经角质酶处理和正己烷萃取效果比较 (A)角质酶100
U /g_织物,在pH 8的50 mM, Tris-HCl中30℃处理30分钟; (B)用正-己烷 在75oC、30分钟萃取棉织物; (C)空白 |
由图8可见,用角质酶处理后的棉织物结构接触角为70°,与用正-己烷萃取的68°非常接近,果胶去除率都很低。
(*作者用美国纺织研究院的自动孔隙仪(TRI auto-porosimeter)测定结构接触角,织物中孔的有效半径Reff=2γcosθ/△P,式中γ、θ和△P分别为表面张力、接触角和孔内外压力差。其优点是测得的接触角与织物的纱线内和纱线间孔隙大小及分布无系。)
由图扫描电镜图9可见,空白试样(C)的纤维表面有光滑的棉蜡层。而角质酶处理的(A)和用正-己烷萃取(B)的棉纤维,其光滑表面的棉蜡层消失,显露出纹理粗糙的初生胞壁。
|
|
|
图9 不同处理棉纤维表面的电镜扫描 |
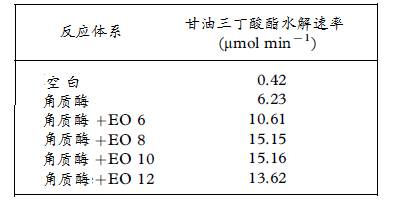
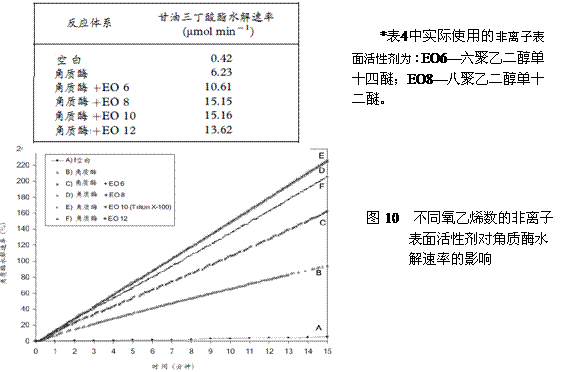
为了提高精练剂等对织物的润湿性,在精练液中都含有表面活性剂,但阴离子表面活性剂会降低角质酶活性,不宜使用。Agrawal用不同氧乙烯(EO)数的非离子表面活性剂与角质酶共用,以甘油三丁酸酯(tributyrin )为底物,测定其水解速率和水解百分率。并以此配方的工作液处理棉织物,研究不同氧乙烯(EO)数对角质酶活性的影响及其精练效果,结果如表4和图10所示。
表4 不同氧乙烯数对角质酶水解速率的影响
|
|
|
|
|
|
|
图10 不同氧乙烯数的非离子表面活性剂对角质酶水解速率的影响 |
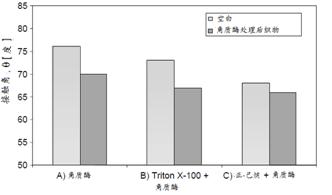
由Agrawal以织物结构接触角来衡量不同氧乙烯(EO)数非离子表面活性剂的润湿性试验指出:E06、E08、E010(Triton X-10)较E012为好,并对不同角质酶处理棉织物的接触角进行比较,其结果如图11所示:
|
|
|
图11 不同角质酶处理的接触角 A) 角质酶处理100U/g,30℃,30分钟PH=8(Tris-Hd缓冲) B) 在上述角质酶处理时加入Triton
X-100 1g/L C) 角质酶处理后,再经正己烷75℃萃取30分钟 |
(2)角质酶的活性测定方法简介
根据国内外资料,角质酶的活性测定方法主要有以对硝基苯丁酸酯(p-nitrophenylbutyrate -PNPB)为底物的分光光度法和以甘油三丁酸酯(tributyrin
)为底物的pH-stat法。
1)以对硝基苯丁酸酯(p-nitrophenylbutyrate -PNPB)为底物,用分光光度仪连续测定在波长405 nm处吸光度,测定角质酶水解底物所释放产物-对硝基苯酚的量,来测试酶的活力。方法如下:用连续分光光度法在20 ℃下进行. 反应体积为1 mL,包括20 μL酶液和980 μL含50 mmol/L对硝基苯丁酸酯(pNPB)、50 mmol/L硫磺脱氧胆酸钠、20 mmol/L Tris–HCl缓冲液(pH值8.0),在405 nm处,记录对硝基酚的生成速率. 酶活定义:在20 ℃,每分钟催化对硝基苯丁酸酯水解生成1 μmol对硝基酚的酶量即为一个酶活力单位.
2)2007年Agrawal等人报导沿用Vertommen等人 在2005年介绍的方法。以甘油三丁酸酯(tributyrin )为底物,在pH-stat*仪器上,30oC、20分钟连续用0.01M的NaOH标准溶液滴定,测量角质酶的活性。以1分钟酶促甘油三丁酸酯水解而释放1 mmol 脂肪酸的酶量定为1单位(U)。此方法也用于测定角质酶对棉织物中角质类以及在各种非离子表面活性剂共存时的水解活性,其方法简述如下:在pH-stat*仪器上,取0.5克棉织物置于含有角质酶的pH9.5的2mmol硼砂缓冲液中,在30oC处理15分钟,由于pH9.5大于棉织物上多数C16脂肪酸的pK值,所以水解释出的酯肪酸带负电荷,可在pH-stat*仪器上,30oC、20分钟连续用0.01M的NaOH标准溶液滴定C16-18脂肪酸,研究角质酶对棉织物蜡质的水解活性。
(*pH-Stat是在仪器上用连续注入碱或酸,中和反应过程中释放的酸或碱,以保持反应体系pH恒定,从而按所耗用碱或酸的量,测定化学反应动力学的一种方法。)
(3)角质酶的最适应用参数
通过pH、温度、浓度、和处理时间等试验,获得下列最适应用参数:
最适pH:有人用甘油三油酸酯或甘油三丁酸酯两种底物作角质酶的酶促反应速率试验,测得的最适pH分别为9-10和8.5,似其最适pH为8-9。
最适温度:30oC。大于40oC, 角质酶失活。
最适浓度:角质酶浓度在100U/g时,其处理织物的结构接触角最小(70o)
最佳处理时间:15分钟。
在处理浴中,加入合适的非离子表面活性剂或与选定的阴离子表面活性剂共用,可明显提高角质酶的处理效果。
(二)果胶酶(Pectinases)
(1)作用与类别
果胶酶是一类以果胶为底物,通过酶促水解或裂解反应,使果胶去除酯基和降解,生成半乳糖醛酸低聚物、半乳糖醛酸或半乳糖醛酸(甲)酯的多组分复合类酶的总称。
用果胶酶精练,既能去除棉纤维初生胞壁和卷绕层中的果胶质,也能使其中半纤维素和糖蛋白等其它非纤维素类物质从果胶质中解脱出来,有效的解除染整加工的第二道“屏障”,达到精练效果。
据报道,已有四十多种微生物能产生果胶酶,其中研究和应用较多的是霉菌果胶酶,其次是细菌果胶酶。其中霉菌果胶酶多数是酸性酶,而细菌果胶酶则主要是碱性果胶酶。
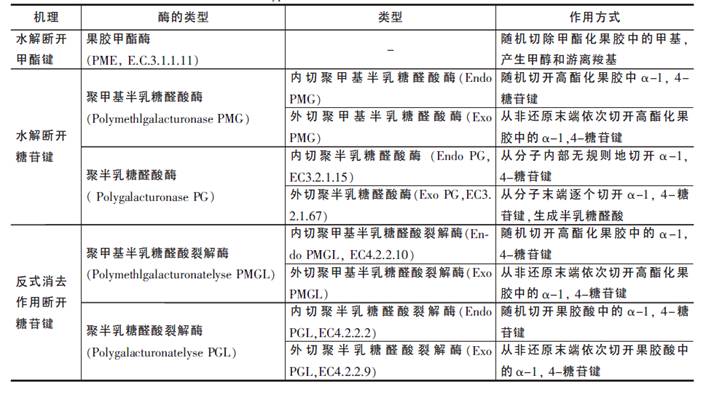
自然界中,果胶酶广泛存在于植物以及真菌和细菌等微生物中(通常动物细胞不能合成这类酶),主要有使甲酯化果胶脱除甲基的果胶酯酶(pectin esterases)、使果胶分子链1,4苷键水解的聚半乳糖醛酸(水解)酶(polygalacturonases简称PG)和通过消除反应使果胶分子链1,4苷键裂解的聚半乳糖醛酸裂解酶(Polygalacturonate lyse简称PGL)。
在EC分类中,果胶酯酶和聚半乳糖醛酸酶同属水解酶类,按其水解底物和反应部位不同,它们分别归属为:果胶酯酶(EC 3.1.1.11)、内切聚半乳糖醛酸酶(endo PG,EC 3.2.1.15)和外切聚半乳糖醛酸酶(exo PG,EC 3.2.1.67)。
果胶酯酶(pectin esterases):
EC3.水解酶(Hydrolases. )
3. 1. 作用在酯键部位(Acting on ester bonds )
3. 1. 1. 羧酸酯水解酶(Carboxylic ester hydrolases )
3.1.1.11 果胶酯(水解)酶(Pectinesterase )
聚半乳糖醛酸(水解)酶(polygalacturonases):
EC 3. 水解酶(Hydrolases)
3. 2. 糖基化酶(Glycosylases)
3. 2. 1.-糖苷酶(Glycosidases),即酶促反应使糖化合物中 O- 和 S-键水解
3.2.1.15 内切聚半乳糖醛酸酶(Polygalacturonase )
3.2.1.67 外切聚半乳糖醛酸酶(G alacturan 1,4-alpha-galacturonidase )
3.2.1.82 外切聚半乳糖醛酸酶(exo-poly-alpha-galacturonosidase),在非还原端水解生成半乳糖醛酸二糖。
在EC分类中,果胶裂解酶属裂解酶类(lyase),EC分类为EC.4.2.2.X, 按其水解反应的部位不同,又分为: 内切聚半乳糖醛酸裂解酶(endo PGL,EC.4.2.2.2)、外切聚半乳糖醛酸裂解酶(exo PGL,EC.4.2.2.9) 两者均为pectate lyase;聚甲基半乳糖醛酸裂解酶(又称pectin lyase),资料中只见内切型聚甲基半乳糖醛酸裂解酶(Endo PMGL,EC.4.2.2.10,),而外切型(Exo PMGL)目前未见报导。
果胶裂解酶(pectate lyase和pectin lyase):
EC
4.-Lyase 裂解酶-通过反应(除水解和氧化反应外)而断裂C-C, C-O, C-N 键的酶
4.2.-作用在 C-O键的裂解酶(Carbon-Oxygen Lyases)
4.2.2.底物为多聚糖(Acting on Polysaccharides)
4.2.2.2
内切聚半乳糖醛酸裂解酶(pectate
lyase)
4.2.2.9外切聚半乳糖醛酸裂解酶(pectate disaccharide-lyase),又称果胶酸盐二糖裂解酶
4.2.2.10
内切聚甲基半乳糖醛酸裂解酶(pectin
lyase)
果胶酶分类如表5所示:
表5 果胶酶分类
|
|
|
|
(2)果胶酶的酶促反应
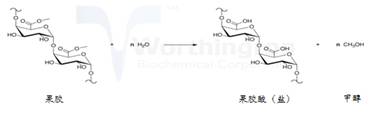
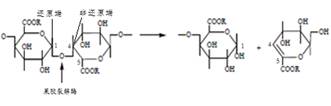
1)果胶酯酶(EC3.1.1.11)是羧酸酯水解酶,它使高度酯化的果胶上的酯键水解脱去甲基,生成聚半乳糖醛酸(盐)和甲醇。
果胶酯酶的化学反应如(5)式所示:
|
|
|
(5) |
由于果胶酯酶只去除果胶中的酯基团,不降解果胶大分子。因此不宜用作为棉的精练剂。
2)聚半乳糖醛酸酶(polygalacturonidases简称 PG)
聚半乳糖醛酸酶(PG)是酶促聚半乳糖醛酸的α-1,4苷键水解反应的一种果胶酶。根据水解作用的部位不同,可分为内切聚半乳糖醛酸酶(endo- PG, E.C.3.2.1.15)和外切聚半乳糖醛酸酶(exo- PG, E.C.3.2.1.67)。外切酶又可按酶源不同,分成两种类型:一种是真菌外切聚半乳糖醛酸酶,它的最终产物是半乳糖醛酸单体;另一种是细菌外切聚半乳糖醛酸酶(EC 3.2.1.82),它的最终产物是半乳糖醛酸的二聚体。
聚半乳糖醛酸酶的物化和生物性能可以从不同微生物源分离出聚半乳糖醛酸酶,但它们的物化、生物性能和作用模式有明显的差异。其中大多数PG酶的最佳作用pH在酸性范围(3.5-5.5),最适宜的温度范围为30-50℃。也有少数,如从地衣芽孢杆菌无毒菌株( BacillusLicheniformis)和尖孢镰刀菌(Fusarium oxysporum)分离的PG酶,其最佳作用条件在碱性范围(pH11)和较高的温度(69℃)。
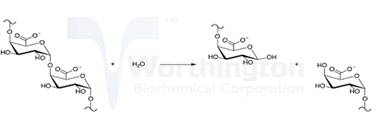
内切聚半乳糖醛酸酶化学反应如(6)式所示:
|
|
|
(6) |
内切聚半乳糖醛酸酶的反应部位在果胶分子链的内部,生成分子链较短的果胶低聚体,继续内切反应,分子链聚合度不断降低,最后降解成半乳糖醛酸单体。
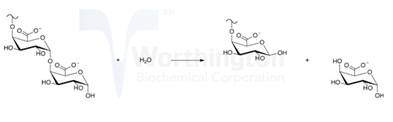
外切聚半乳糖醛酸酶化学反应:
大部分真菌分泌的外切聚半乳糖醛酸酶,其反应部位发生在果胶分子链的端部,生成半乳糖醛酸单体,如(7)式所示:
|
|
|
(7) |
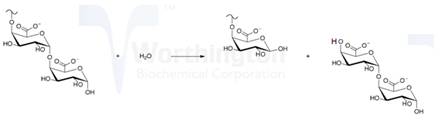
但也有某些细菌分泌的外切聚半乳糖醛酸酶,其反应部位也在果胶分子链的端部,但生成的产物是半乳糖醛酸二聚体。反应如(8)式所示:
|
|
|
(8) |
(3)果胶裂解酶(pectin
lyases,PL)的酶促反应
果胶裂解酶(又称反式消去酶),是以消去反应(β-elimination)催化果胶裂解的一种果胶酶。裂解反应发生在果胶分子链中两个相邻半乳糖醛酸残基间非还原端一侧残基的C-4糖苷键处。反应使这残基的C-5处失去一个H原子,供给还原端残基上C-1的—O结合形成-OH,同时在非还原端残基的C-4和C-5间产生一个不饱和键,生成不饱和的Δ4,5-D半乳糖醛酸如(9)式所示
|
|
|
(9) |
根据果胶的酯化度和反应的部位,果胶裂解酶又可分为:
1)果胶酸(盐)裂解酶Pectate Lyases
因为果胶酸(盐)裂解酶(PGL)的优先(preferential)底物为未酯化或酯化度很低的的果胶,故英文名为Pectate lyase。它通过反式消除反应使未酯化或酯化度很低的果胶聚半乳糖醛酸(polygalacturonic acid)的糖苷键断裂,生成不饱和的Δ4,5-D半乳糖醛酸盐。根据其反应部位不同,果胶酸盐裂解酶可分为:(1)内切聚半乳糖醛酸裂解酶(endo PGL,EC.4.2.2.2),其反应部位无规地在分子链中间;(2)外切聚半乳糖醛酸裂解酶(exo PGL,EC.4.2.2.9) , 其反应部位在分子链的端部。又因细菌型外切聚半乳糖醛酸裂解酶的外切裂解产物为二聚体,所以有人称它为果胶酸盐二糖裂解酶(Pectate disaccharide-lyase)。值得注意的是,果胶酸(盐)裂解酶的酶促反应必须有Ca2+,所以EDTA(乙二胺四乙酸)等金属螯合剂对其酶促反应有很强的抑制作用。
2)果胶裂解酶Pectin Lyases
因为果胶裂解酶的优先底物为高酯化度的果胶,故其英文名为Pectin lyase。它通过反式消除反应,随机地使高酯化度的果胶,如聚甲基半乳糖醛酸(polymethylgalacturonic acid)分子链中糖苷键断裂,生成不饱和的Δ4,5-D甲基半乳糖醛酸低聚物。据称,目前所报导的果胶裂解酶,都是内切果胶裂解酶(endo PL,EC.4.2.2.10), 其酶促反应不一定需要Ca2+,但可被Ca2+和其它阳离子激活。据Van Alebeek的研究表明,由黑曲霉(Aspergillus niger)制得的果胶裂解酶,其酶促反应产物为不饱和半乳糖醛酸的二聚、三聚和四聚物,但未检出不饱和半乳糖醛酸的单体。
这两类裂解酶在CAZy分类中,归属为第一族,多聚糖裂解酶(family 1, polysaccharideslyase),由真菌制得的裂解酶,其最佳活性在酸性和中性介质;而由细菌培养制得的裂解酶,其最佳活性在碱性介质中。
有人研究认为,β-消除反应只发生在果胶分子链中与甲酯化羧基相邻的糖苷键上,所以果胶的甲酯化程度越高,其降解速度也越快。
综上所述,果胶裂解酶最适pH在碱性范围,所以有人把果胶裂解酶称为碱性果胶酶(Alkaline pectinases),而把最适pH在酸性范围的聚半乳糖醛酸酶称为酸性果胶酶(Acidic pectinases),但事实上却有少数例外,如从地衣芽孢杆菌无毒菌株(BacillusLicheniformis)和 尖孢镰刀菌(Fusarium oxysporum)分离的聚半乳糖醛酸酶,其最适pH=11。
(4)果胶酶活力和酶的比活力及其测定
酶活力是表征酶促反应的催化能力。标准的酶活力单位(U)定义是:在特定条件(25℃,其它为最适条件)下,在1分钟内能转化1μmol底物的酶量,或是转化底物中1μmol的有关基团的酶量。由于按此定义表示的数据要用小数或毫U表示,不方便。酶供应商往往用:1分钟能转化1nmol底物或有关基团的酶量来定义酶活力的单位。
酶的比活力(specific activity):是指每毫克(质量)蛋白质中所含的某种酶的催化活力,U/mg。它是用来度量酶纯度的指标。是生产和酶学研究中经常使用的基础数据。
果胶酶活力测定方法:首先测定不同时间酶促反应时生成的产物,以产物浓度为纵座标、时间为横座标,制作酶反应进程曲线图。在反应开始后某一较短时间段内,曲线呈直线,表示产物的生成速度与时间成正比,其斜率代表酶促反应的初速度。随着反应时间延长,底物浓度降低和产物浓度增高,导致逆反应增强,反应速度下降,此时进程曲线的切线斜率逐渐变小,直至曲线趋向平坦,此时表示再继续延长时间,反应速度几乎不变。所以测定酶活力的反应时间应选择在曲线呈直线的这一时间段内。
聚半乳糖醛酸酶(EC3.1.1.15)的活力测试方法
除了在食品工业用果胶粘度下降法测试聚半乳糖醛酸酶(EC 3.1.1.15)的活力外,在化学方法方面,主要是根据聚半乳糖醛酸酶对果胶的酶促水解产物--D-半乳糖醛酸具有还原性,采用各种还原糖的测定方法来测试其活力。
活力单位(U)的定义:在37℃和pH=5条件下,1分钟从聚半乳糖醛酸分解释放1μmolD-半乳糖醛酸的酶量。下面是几种测试方法简介:
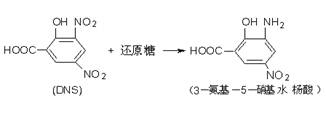
1) DNS (3,5-二硝基水杨酸)法,是应用较多的方法之一。
原理:在NaOH和丙三醇存在下,3,5-二硝基水杨酸(DNS)与聚半乳糖醛酸的酶解产物--D-半乳糖醛酸(还原糖)共热后,被还原生成氨基化合物。在过量的NaOH碱性溶液中此化合物呈桔红色,在540nm波长处有最大吸收,在一定的浓度范围内,还原糖的量与吸光度呈线性关系。用分光光度计先制作D-半乳糖醛酸标准曲线,然后测定酶促反应后样品中的D-半乳糖醛酸含量。其反应如(10)式所示:
|
|
|
(10) |
2)I2-Na2S2O3(碘-硫代硫酸钠)法。基于果胶酶对聚半乳糖醛酸的酶解产物--D-半乳糖醛酸具有还原性糖醛基,可用次亚碘酸法 定量测定,以淀粉为指示剂,用Na2S2O3滴定过量的I2(见中华人民共和国行业标准 QB 1502-92“果胶酶活力测试”和Sigma-Adrich手册)。
3)新亚铜试剂法。基于试剂CuSO4中的Cu2+与具有还原性糖醛基的酶解产物-- D-半乳糖醛酸反应生成Cu+,它与新亚铜试剂生成有色化合物,在波长为450nm处有吸收峰,在一定的浓度范围内,它与吸光度A呈线性关系,用分光光度计测定样品中的-D-半乳糖醛酸含量(见Worthington 手册)。
(5)果胶裂解酶活力测定
原理:在果胶裂解酶的酶促反应下,果胶分子和水通过消除反应生成Δ-4,5烯键的半乳糖醛酸单体或低聚物,在波长235nm处有不饱和的Δ4,5-D半乳糖醛酸特征吸收峰,用分光光度计连续测定5分钟(曲线呈线性范围内)的果胶裂解酶的酶促反应速率。按每分钟吸光度增值(ΔA235nm/分钟)为1定义为酶的活力单位。
四、果胶酶和果胶裂解酶在棉精练的应用
在讨论棉的酶精练前,值得一提的是,1)无论从真菌或细菌培养制得的果胶酶粗液,还是经过分离提纯的酶制剂,都是果胶酶和其他酶的混合物,也就是以某一酶为主,而混有其他酶的混合体。2)即使属同一类酶,同一EC编号,其活力和最适条件等性能也随酶源(菌株)不同而有很大差异。3)酶生产厂商为了提高酶制剂的精练效果,商品酶制剂多是几种酶配伍的混合体,其中还加有稳定剂、乳化剂和表面活性剂等。4)酶活力和酶的比活力是酶制剂品质的重要指标,在研究开发和生产酶制剂时,酶活力测定是必做的项目之一,但是测试条件(如底物浓度、温度、缓冲剂等)不同,测得的数据差异很大,所以印染厂在使用某一批号的果胶酶制剂时,除了要了解这批果胶酶制剂的类别(水解酶还是裂解酶)、酶活力、最适条件、其他组分和稳定性等数据外,在可能的情况下,还应向供应商了解其活力测试方法。如果有条件的话,还应在实验室中,模拟实际应用条件进行效果测试,这样才能科学地设计工作液组成和精练工艺条件。
根据资料介绍,最早(1995年)使用果胶酶、蛋白酶、脂肪酶和纤维素酶进行棉的酶精练研究者是,德国Schacht、 Rößner等人。此后,经过很多人的继续研究(如Li &Hardin, 1998; Hartzell & Hsieh, 1998; Buchert et al., 2000;Traore & Buschle-Diller, 2000;Galante & Formantici, 2003),认为,果胶酶和纤维素酶的精练效果显著,脂肪酶次之,蛋白酶最差。
近年来国内外有很多资料介绍用果胶酶-角质酶、果胶酶-纤维素酶、果胶酶-纤维素酶-蛋白酶和果胶酶-半纤维素酶等组合,研究它们对果胶去除率、织物的亲水性、白度、织物的物理性能变化和染色匀染性等性能的影响。因为棉纤维初生胞壁的最外层富含部分甲酯化的果胶,而碱性最适裂解酶(如Novozymes Bioprep 3000L)的β-消除反应只发生在果胶分子链中与甲酯化残基相邻的糖苷键上,其果胶的降解效果优于酸性果胶酶。此外,精练的前后工序多是在碱性条件下进行的,裂解酶精练有利于工序的衔接,所以碱性最适的裂解酶尤为人们所关注。
很多研究者认为,仅用果胶酶精练脱除果胶并不能使织物具有优良的亲水性,果胶酶-角质酶、果胶酶-纤维素酶等组合、精练前织物先用1000C水预处理、精练时对织物施加机械力和超声波等方法,都能使精练后织物具有和常规碱精练同样优良的亲水效果。
(一)试验方法与结果
Agrawal用所谓统一试验方法*,以结构接触角和钌红染色法测定的残留果胶**作为处理效果的指标,把A-未经任何处理、B-经正己烷萃取(750C萃取30分钟)蜡质后和C-经传统碱精练作为三个标样,比较三个酸性果胶酶和三个碱性果胶裂解酶的酶精练效果。
(*统一试验方法:试验织物为280g/m2全棉平纹织物。在置有500毫升含酶和pH8的Tris-Hcl缓冲溶液的1000毫升烧杯中
放入3块5×12cm的织物,在规定条件下处理后,取出试样,用500毫升900C热水处理15分钟,使酶失活,再用冷水5分钟水洗两次,然后将试样平放在平整的有机玻璃上,凉干24小时后进行各项测试。每个试验都重复两次。)
(**钌红染色法是测定精练后棉织物上果胶相对残留量的简单实用方法。具体操作如下:取两块要测定果胶的布样和一块坯布(设定果胶含量为100%)以及一块碱精练过的布样(设定果胶含量为0%)缝合成直径为8cm布环。将此布环放入按100ml/g织物用量的染色溶液中。染浴组成:钌红0.2g/l+1g/l表面活性剂混合液(Silwet
L-77 and Tergitol 15-S-12)。室温染色15分钟,染色后取出布环,置于Linitest实验室染色机中,用60℃的去离子水洗涤10分钟。布环凉干后,用测色仪在波长为540nm处测其反射率R,并按Kubelka Munk*公式分别计算K/S(试样)、K/S0(碱精练后)和K/S100(原坯)值。用下列公式计算试样的果胶相对残留量:
![]()
)
(1)三个标样:
(A)未经任何处理的试样的结构接触角为830, 设定其果胶去除率为0%;
(B)经正己烷萃取(750C萃取30分钟)蜡质后的试样,其结构接触角为~680,设定其蜡质去除率为100%;
(C)经传统碱精练的试样为,其结构接触角为530,设定其果胶去除率为100%。
以上三个标样的比较如图12所示
|
|
|
图12 不同予处理试样对织物结构接触角影响 |
(2)酶精练处理条件:所有酶浓度均为100 U/g、最适pH酸性果胶酶pH5*、碱性果胶裂解酶pH8**、500C,30分钟,
(* 50mM醋酸盐缓冲液;**
50mM Tris-HCl缓冲液。)
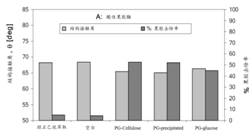
酸性果胶酶:
三个酸性果胶酶都是从真菌Sclerotium rolfsii(齐整小核菌)中分离,但分别用葡萄糖和纤维素二种不同的培养基制得,即
1) 葡萄糖为培养基:PG-glucose,属内切聚半乳糖醛酸酶(EC3.2.1.15),
2) 纤维素为培养基PG-cellulose, 属外切聚半乳糖醛酸酶(EC3.2.1.67),
3)是经过沉淀制得的PG-precipitated,也属外切聚半乳糖醛酸酶。
它们在500C和pH5时的半衰期为10小时,但在pH8时只有20分钟。
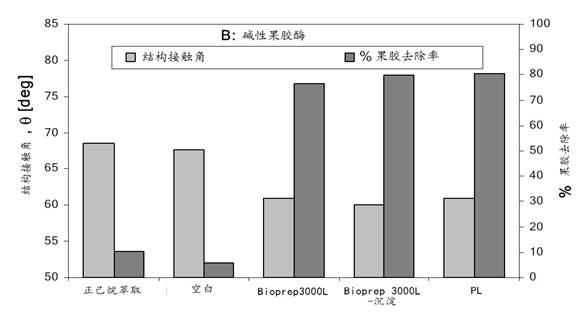
碱性果胶裂解酶
三个碱性果胶裂解酶分别为:
1)Novozymes Bioprep 3000L,它是单一果胶酸裂解酶(pectate lyase)的商品制剂,其最适pH8-9。
2)为了剔除Bioprep 3000L中其它组分的影响,使用前先经硫酸铵沉淀提纯。
3)从短小芽胞杆菌(Bacillus pumilus)分离的嗜碱细菌产生的内切果胶酸裂解酶(PL EC 4.2.2.2),最适pH为8.5(Tris-HCl,即三羟甲基氨基甲烷-盐酸缓冲体系)。它在300C时半衰期为75小时。酶促反应时不需要Ca2+,EDTA和Co2+对反应有强的抑制效应,当果胶分子链的酯化度大于50%时,此裂解酶的活力会降低。
(3)试验结果如图13、14和表6所示:
|
|
|
图13 酸性果胶酶的处理效果 |
|
|
|
图14 碱性果胶酶的处理效果 注:图13、14中“空白”为正己烷萃取后的棉织物,在无酶剂存在下处理的空白试样 |
表6 两种果胶酶处理效果比较
|
|
果胶去除率 |
结构接触角θ |
|
酸性果胶酶(PG) |
45%-52% |
∼66° |
|
碱性果胶裂解酶(PL) |
76%-83% |
∼60° |
|
未经任何处理的试样 |
设定为0% |
∼830 |
|
正己烷萃取(750C萃取30分钟)的试样 |
<7% |
∼680(设定蜡质全部去除) |
|
经传统碱精练试样 |
设定为100% |
∼530 |
试验结果表明,1)碱性果胶裂解酶的果胶去除率比酸性果胶酶高达75%以上,两者结构接触角分别为∼60°和∼66°,前者比后者小∼6o,但都小于正己烷萃取的试样(∼680);2)三个酸性果胶酶中, PG-cellulose和PG-precipitated的果胶去除率高于PG-glucose,而三者的结构接触角都小于正己烷萃取的试样(∼680);3)三个碱性果胶裂解酶的精练效果(果胶去除率和结构接触角)接近。
有报导称,果胶的酯化度高,会降低果胶因酸性水解的降解速度,而碱性pH可加快反式消除反应速度和酯化果胶的脱甲酯化。它还有助于棉初生壁外层中二个甲酯化果胶大分子间相互作用的断开。
由此Agrawal认为,碱性果胶裂解酶的精练效果优于酸性果胶酶,并以碱性果胶裂解酶(PL)作进一步的实验。
(二)蜡质去除对果胶酶(PL)精练效果的影响
如前所述,棉纤维表面的蜡质层会阻碍果胶酶向棉初生壁表面的果胶层渗透。因此,蜡质层的去除有利于果胶酶功能的发挥。为了证实这个论点,进行下列两组试验:
A组:织物先经α)沸水预处理2分钟、b)100oC pH8(50mM Tris-HCl)缓冲液预处理2分钟、c)经正己烷75oC萃取30分钟,继后分别用果胶酶(100 U/g PL,50oC 30分钟)处理。
B组:织物先经上述同样的预处理,继后分别用果胶酶(100 U/g PL)+非离子表面活性剂(Triton X100,1g/l)进行50°C 30分钟酶处理。
两组试样的测试结果如图15、16所示:
|
|
|
图15 不同去除蜡质予处理对果胶裂酶效果的影响 |
|
|
|
图16不同去除蜡质予处理对Triton X-100和胶裂介酶处理的效果影响 |
1)A组中三个预处理(空白)和继后三个用PL处理的试样都能降低织物的结构接触角,其中正己烷预处理和继后PL处理的结构接触角下降最明显。
2)B组中三个加Triton X-100的预处理(空白)和继后三个用PL+ Triton X-100处理试样的结构接触角均比A组不加Triton X-100的有不同程度下降,其中尤以正己烷预处理和继后PL处理的下降最显著(只有55o)。
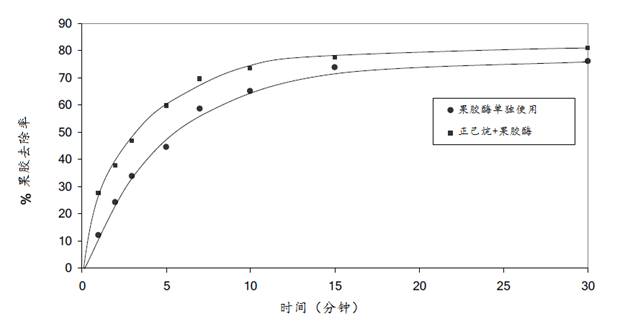
为了进一步证实角质层去除确实有利于果胶酶对果胶的去除,又进行了●单用果胶酶处理和■正己烷预处理+PL处理两组的反应速率测试(两组的PL用量均为13 U/g 织物)。两组试验的(果胶去除率)反应速率曲线如图17所示。
|
|
|
图17 正己烷予处理对果胶去除率的影响 |
由图17可见,反应初期的曲线呈线性(一级反应),按一级反应曲线的63%(果胶去除率)方法计算时间常数(time constant*),则正己烷预处理+PL处理的时间是5.5分钟;而单用果胶酶处理的则需要9分钟,前者的反应速率是后者的1.65倍。在30分钟后的果胶去除率方面,前者可达76-80%,而后者只有70%。上述实验结果证明,蜡质层的去除可明显加快果胶酶的酶促反应速率。(*63%是表征一级反应曲线的一个参数)
(三)果胶酶精练的主要参数
果胶酶浓度、pH。温度、螯合剂和表面活性剂等是酶精练的主要参数。
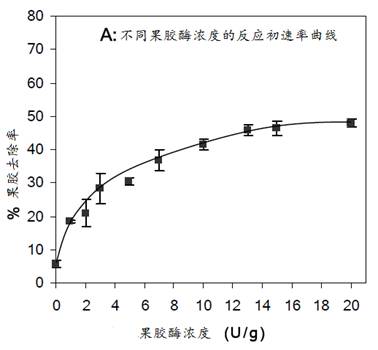
(1)果胶酶浓度试验
取10块退浆后织物分别在pH8的50mMTris-HCl缓冲液和果胶酶浓度从1U/g逐步递增到20U/g的酶溶液中,经温和的摇动下50oC处理5分钟。然后测定每块处理后织物的果胶去除率,制作果胶酶浓度对果胶去除率的相关曲线,如图18所示。
|
|
|
图18 果胶酶浓度的影响 |
结果表明,当果胶酶浓度在1U/g时,其果胶去除率只有6%,当浓度为5U/g、10U/g和13U/g时,去除率分别增至30%、41%和46%,继续增加果胶酶浓度,果胶的水解速率无明显增加。
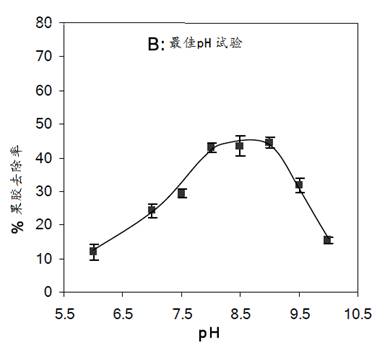
(2)最佳pH选择
在其他相同试验条件下(以下同),用50mM醋酸盐、Tris-HCL或硼酸盐缓冲液调整pH在6、7、7.5、 8、 8.5、9、9.5、和10的PL果胶酶处理液精练织物,然后测定每块处理后织物的果胶去除率,制成下列曲线,如图19所示:
|
|
|
图19 PH值的影响 |
由上图可见,当处理液在pH6(用二次蒸馏水取代缓冲液)时,果胶去除率仅为11%,而pH8-9时果胶去除率可达45%,这与PL的等电点为8.5相一致。
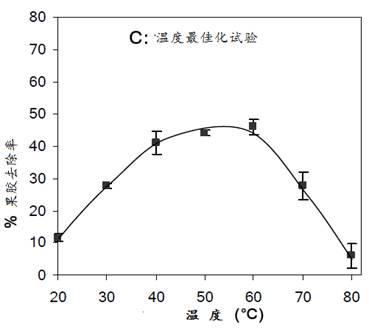
(3)最适温度试验
试验的温度范围选择在20oC和80oC间, 每一处理的温度间隔10oC, 然后测定每块处理后织物的果胶去除率,结果如图20所示。
|
|
|
图20 PH值的影响 |
由上图可见,温度对PL酶促反应速率有显著的影响,在20oC和30oC时,果胶去除率仅为15%和36%。当温度升至50oC时,果胶去除率达到峰值(46%),升温至60oC时,结果几乎没有变化。此后继续升温至70oC时,由于高温使PL酶失活,果胶去除率又下降至27%。
(4)螯合剂类别和应用程序的选择
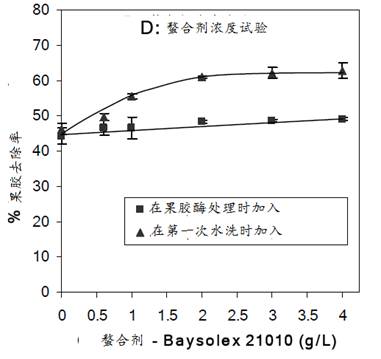
如前所述,果胶酸(盐)裂解酶的酶促反应必须有Ca2+,精练浴中加入EDTA(乙二胺四乙酸)等金属螯合剂对其酶促反应有很强的抑制作用。而果胶裂解酶的酶促反应,则无此现象。又知在棉纤维的卷绕层(初生壁与次生壁间)中,主要是未酯化或酯化度很低的果胶,这类亲水的酸性果胶分子链带有负电荷,对Ca2+等金属阳离子有很强的吸引力,从而使相邻的酸性果胶分子链间形成交联,使酸性的果胶大分子结合在一起组成蛋形结构,金属螯合剂可螯合蛋形结构中的Ca2+等金属阳离子,从而解开它们的结合,有利于果胶的去除。所以金属螯合剂对棉的精练效果有正、反两个方面的作用。鉴于精练浴中含有少量EDTA(0.5g/l)就能使裂解酶失活,且EDTA在污水处理时被水解,对人体亦有一定的毒性。继后有人试用影响较少的柠檬酸三钠和亚胺二琥珀酸钠盐类(如Bayer公司的商品Baysolex 21010)等螯合剂,并研究后者的两种加入方式,即1)螯合剂和果胶酶同浴,2)螯合剂在果胶酶处理后第一道95oC热水洗(15分钟)时加入。结果如图21所示:
|
|
|
图21 鳌合剂的影响 |
由图可见,与同浴加入相比,在第一道热水洗时加入2g/l
Baysolex 21010,可明显提高果胶去除率(从45%提高至63%)。这可理解为,在碱性果胶裂解酶处理后,初生壁中果胶先被去除,接着在第一道水洗时,螯合剂再去除卷绕层中蛋形结构中的Ca2+,使深埋的低酯化果胶大分子游离出来,经热水洗除,从而进一步提高了果胶去除率。
(四)角质酶和果胶酶的联合精练
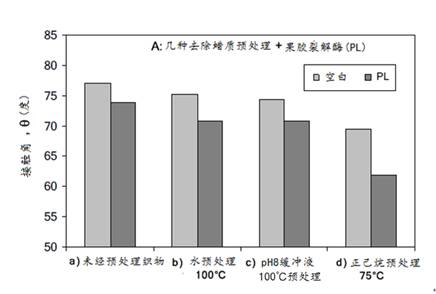
如前所述,正己烷有优良的棉蜡萃取效果,有利于初生壁中果胶与果胶酶接触,明显提高果胶的去除率。但在生产中用正己烷作预处理并不现实。对此,近年来国内外有人研究了用角质酶预处理或/和与果胶酶同浴处理的试验。
角质酶预处理后的果胶酶精练
步骤1:100U/g角质酶,在50mM Tris-HCl pH=8缓冲液中,30oC处理15分钟
步骤2:13U/g果胶裂解酶,在50mM Tris-HCl pH=8缓冲液中,50oC处理15分钟
5个组合试验:
A- 步骤1和步骤2都是不含酶的空白
B- 步骤1角质酶处理+步骤2不含果胶酶的空白
C- 步骤1不含角质酶空白+步骤2果胶酶处理
D- 步骤1角质酶处理+步骤2果胶酶处理
E- 步骤1含1g/lTriton X-100的角质酶处理+步骤2果胶酶处理
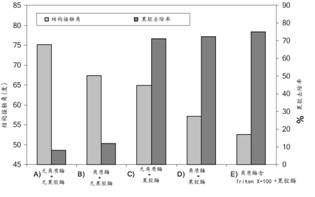
两步处理后所有试样进行∼9710 N/m2的机械作用、标准水洗和干燥处理结果如图22所示:
|
|
|
图22 单独和二步法处理的效果比较 |
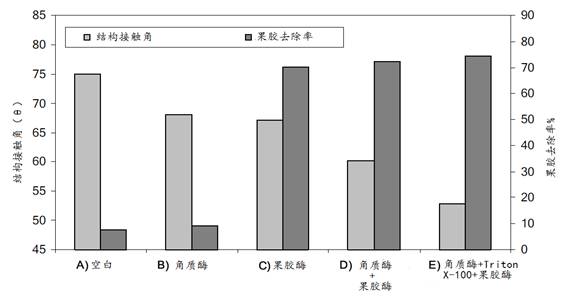
由图可见,单独角质酶(B)或单独果胶酶(C)处理都能使结构接触角从75o降低到~67o。在果胶去除率方面,(B)处理的只有9% ,而(C)处理的可达70%。(D)角质酶预处理+果胶酶和(E)在角质酶预处理时加入Triton X-100表面活性剂处理的,果胶去除率没有变化,而结构接触角则分别降低至57o和51o。
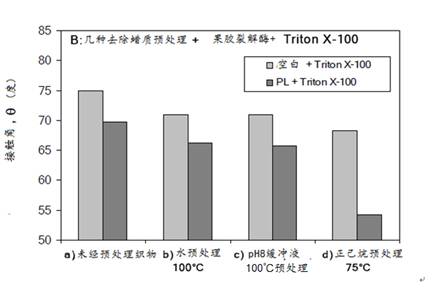
(五)角质酶和果胶酶同浴精练
要实现角质酶和果胶酶同浴精练前,必须先澄清下列几个问题:
1) 角质酶和果胶酶同浴不能相互影响彼此的酶促反应活力。通过角质酶和果胶酶同浴时,两种酶的活力测试,证明两者是相容的。
2) 如前所知,角质酶和果胶酶的最适温度分别为30oC和50oC,而角质酶在>40oC时失活。所以两者同浴精练的温度宜在30oC,但要获得理想效果,必须提高果胶酶的浓度。
角质酶和果胶酶同浴精练的条件:在在50mM Tris-HCl pH=8缓冲液中,30oC处理15分钟,处理后进行∼9710 N/m2的机械作用、标准水洗和干燥处理。
设计为了5个试验:
A) 空白
B) 角质酶处理
C) 果胶酶处理
D) 角质酶和果胶酶同浴处理
E) 加入1g/lTriton X-100的同浴处理。
结果如图23所示
|
|
|
图23 不同处理效果水平比较 |
由图23可知,角质酶和果胶酶同浴处理织物的结构接触角θ≈60°,明显优于它们单独处理的,这可解释为角质酶去除棉纤维表面的蜡质,有利于果胶酶对初生壁的攻击,加快果胶和其他非纤维素类物质的去除,从而提高了亲水性,而加入1g/lTriton X-100的同浴处理的接触角可达≈52°,水润湿效果与NaOH煮练相当。
五、结语
1、棉纺织品的酶精练新技术的研发约已经历了15年多,国外在这方面的基础性应用研究工作的深度、广度和已取得的进展,值得我们认真的学习和借鉴。目前我国仅在某些棉纺织品上的应用有些介绍,当然,对酶的推广应用是有些帮助的,但对它基础性应用研究报导还未见到,这实疑是限制了它推广应用的手脚。这是值得注意的问题。目前,我国纺织业年耗用棉花约800~900吨,其制品的染整加工中所需的精练酶制剂的国产化问题,也应是国内酶制剂行业关注的问题之一。
2、酶活力对染整界来说犹如染料的力份,使应用人员有雾里看花的感觉,各家厂商的活力测定方法和条件不同,酶活的定义也可能各异,不易从其产品介绍中获得确切信息,更不能作出性价比的判断。为此,请双方能共同携手早日商讨妥然的解决方案。
3、在酶的应用方面,染整行业的科技人员要从“民可使由之”过渡到“民可使知之”后,才能真正建立起绿色棉纺织品酶精练工艺,愿与业界同仁们共勉之。
主要参考资料:
1)Agrawal P.B.-THE PERFORMANCE OF CUTINASE AND PECTINASE IN COTTON SCOURING, Thesis, University of Twente,the Netherlands,(2005)
2)Cristina M. L. Carvalho Cutinase structure, function and biocatalytic applications. Electronic Journal of Biotechnology Vol.1 No.3, Issue of December 15, 1998
3)Pasi Halonen,et al.,A HIGH THROUGHPUT PROFILING METHOD FOR CUTINOLYTIC ESTERASES,VTT BIOTECHNOLOGY
4) V. Brissos et.al Improving activity and stability of cutinase towards the anionic detergent AOT by complete saturation mutagenesis, Protein Engineering, Design & Selection vol. 21 no. 6 pp. 387–393, 2008
5)张瑶等 角质酶及其在纺织工业中的应用中国生物工程杂志 2010,30(9):105—109
6)HACH LANGE Radiometer pH-Stat Theory and Practice
7) SongTao Xie (a Thesis for the degree of MS)Characterization of interyarn pore size and its distribution
8) TRI Auto-porosimeter
9) Danielle Biscaro Pedrolli et al. Pectin and Pectinases Production, Characterization and Industrial Application of Microbial Pectinolytic Enzymes. The Open Biotechnology Journal, 2009, 3, 9-18
10)张学杰等 果胶研究新进展(Journal of Chinese Institute of Food Science and Technology) Feb. 2 0 1 0Vol. 10 No. 1
11)Pectinase Database-Specific activity pectinases enzyme activity enzymatic assay
12)Enzyme Explorer Assays by Enzyme Name Sigma-Aldrich
13)Dashek, William V., ed. Methods in plant biochemistry and molecular biology. Boca Raton, FL: CRC Press: pp. 309-321. Chapter 25.
14)Sigma Enzymatic Assay of PECTINASE (EC 3.2.1.15);Sigma Enzymatic Assay of PECTIN LYASE (EC 4.2.2.10)
15)中华人民共和国行业标准 QB 1502-92 食 品 添 加 剂 果 胶 酶 制 剂
16)Atina.K.Losonczi (Ph.D.Thesis) Bioscouring of Cotton Fabrics
17)Emre Karapinar,et al. Scouring of Cotton with Cellulases, Pectinases and Proteases FIBRES & TEXTILES in Eastern Europe July / October 2004, Vol. 12, No. 3 (47)
18)王强等 棉织物酶练后的果胶质含量测定 论文汇编(2003年11月)
19)范雪荣等 棉纤维润湿性影响因素分析 纺织学报 2004 vol.25 No.1
20)Innova Biosciences:Enzyme units,Activity and specific activity explaned(网上资料)、
21)Miller et,al;Liquid porosimetry New methodology and applications, J.of Coloidal and Interface Science 163 163/170(1994)
22)Novozyme, Determination of pectin removal on Cotton by ruthenium red dyeing SOP NO:EUS-SM-0103, 02/01 1-6 (2003)