酶化学基础知识(二) yd12912
上海纺织科学研究院
邵行洲(退休)
全国染整新技术应用推广协作网 秘书处
二、酶促反应的工作原理
酶和一般化学催化剂一样,它参与化学反应,但反应前后没有质和量的变化,也不改变可逆反应的平衡点。醇和一股化学催化剂不同,酶是蛋白质,它兼有生物大分子的各种特性。
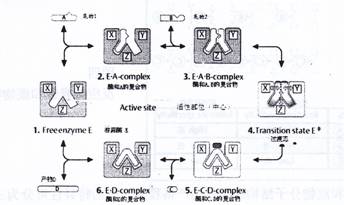
酶促反应的“中间产物”学说:
在酶促反应中,人们称反应前的反应物为底物、反应后为产物。
酶(E)首先与底物(S)生成中间产物——“酶-底物复合物(ES)”,然后这复合物再分解成产物(P)和游离的酶(E)。其过程如图二所示
|
|
|
图二 双底物酶促反应示意图 |
(一)酶促反应的特性
(1)酶有极高的催化效率
一般情况下,酶的催化效率比非催化反应高108-20倍,比非酶催化反应高107-13倍。
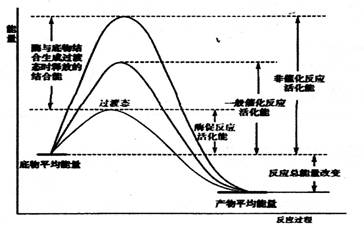
在化学反应中,只有当碰撞的分子能量等于或超过某一定的能量Ec(活化能)的活化分子时,才是有效碰撞,才发生化学反应。使分子从常态转变为容易发生化学反应的活跃状态所需要的能量称为活化能。如图三所示
|
|
|
图三 酶促反应过程中活化能的改变 |
酶促反应速率也与其活化能的大小密切相关,活化能越低,反应速率越快,因此降低活化能会有效地促进反应的进行。
(二)酶促反应的特异挂
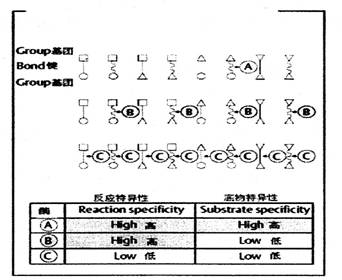
除了酶促反应能在很温和的条件下顺利和高速进行、同时对反应条件(如温度、pH等)有严格的选择性外,醇对底物和反应类型也有严格的选择性。如图四所示:
|
|
|
图四 反应特异性和底物特异性 |
根据酶对化学反应类型和底物分子结构选择性的严格程度,酶的特异性可分为三种类型:
(1)绝对特异性(absolute specifity)——图四中酶A对底物和反应都有高的特异性,也就是说,酶A只能作用于一种底物,进行特定的化学反应,生成特定结构的产物。这种特异性称为绝对特异性。
(2)相对特异性(relative
specificity)——有一些酶的特异性相对较差,这些酶只能作用于一类化合物或一种化学键,如图四中的B酶。这种不太严格的选择性,称为相对特异性。
(3)立体异构特异性(sterospecificity)——这类酶能辨别底物不同的立体异构体,只对其中一种构型起催化作用。包括旋光异构特异性和几何异构特异性。
〈三)酶的活性中心(active
center)或称活性部(active site)
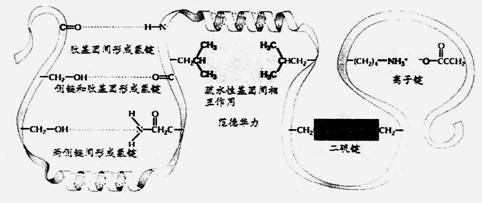
绝大多数酶是蛋白质,是由各种氨基酸分子以肽键连接的线状大分子。由于分子中有-NH2、-COOH基团和各种侧链,它们间存在着氢键、离子键和范德华等引力,少数酶有共价结合,如二硫键,致使蛋白质分子呈“线团”状(三级结构-tertiary structure)。如图五所示
|
|
|
图五 |
酶的活性中心是酶和底物生成复合物、进而发生催化反应的部位。
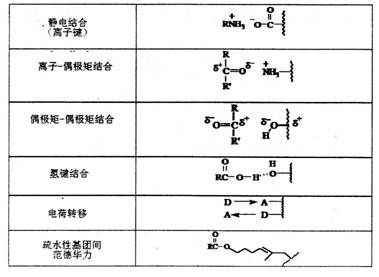
在活性中心中,酶和底物可以通过各基团间的非共价结合,生成酶-底物复合物。如表1所示:
|
表1 酶和底物间的非共价键作用 |
|
|
对一个单纯酶来说,活性中心是指在“线团”状的酶蛋白结构外表面上相互靠近的一些氨基酸残基或其残基上的某些基团组成的区域。活性中心有两类必需基团:―类是能与底物(和辅酶)结合形成酶-底物复合物的结合基团(binding group);另一类是影响底物中某些化学键稳定性的催化基团(Catalytic
group),它能使底物的旧键容易断裂、形成新键,进而底物转化为产物。对于一些需要辅酶的酶来说,辅酶本身或者其分子中某些基团、结构就是活性中心的组成部分。
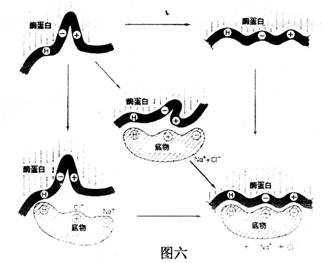
此外,酶分子中还有一些其他基团,它们虽然没有结合和催化功能,但能营造一个使酶的活性中心处于合适的空间构象,如产生凹穴或裂缝,诱导底物与必需基团接近和结合,有人称它为诱导契合(induced fit),如图六所示:
|
|
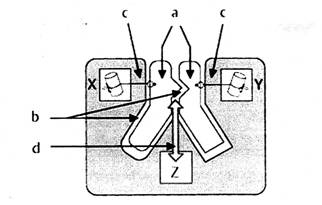
催化反应时,酶的活性中心先后进行:a.底物和酶靠近(approximation)、定位取向(orientation)诱导契合;b.排除表面溶剂化层,如水,使底物和酶更紧密接触;c.过渡态的稳定化和d.基团转移这四个过程。如图七所示:
|
|
|
图七 |
(四)酶的活力(activity)
酶的活力单位:
(1)国际单位(IU):
1961年国际酶学会(the international Union of Biochemistry)提出,I964年被采用。定义:1个酶活力单位是指在特定条件(
*注意:在国际度量衡(CGPM)中,SI)的时间单位是秒(s)不是分钟(min)。
(2)Kata1单位(Kat):
由于上述矛盾,1978年国际度量衡(CGPM)推荐、1999年官方接受,用Katal为酶的活力单位,指在特定条件下、酶被底物饱和时,每秒钟转化1mo1底物所需的酶量,
1IU=1/6O μkatal=16.67n kata1
酶的比活力(specific
activity):
每分钟每毫克酶蛋白在
(3)转换数(Turnover
nunber)Kcat
在酶学中,定义单位时间、每个酶分子中活性部位能使底物转换成产物的最大分子数,它可按下面的米-曼方程式, Kcat=Vmax/[E]T计算求得,式中[E]T为总(total)的酶浓度。
三、酶促反应动力学
酶促反应动力学是研究酶促反应速率以及各种因素对反应速率的影响。这些影响因素有:底物浓度、酶的浓度、pH、温度、抑制剂以及激活剂等。
在酶促反应中,酶(E)首先与底物(S)生成“中间产物——酶-底物复合物(ES)”,然后这复合物再分解成产物(P)和游离的酶。
![]()
(一)底物浓度[S]对酶促反应初始速率(V)的影响
(1)米-曼方程式(Michaelis-Menten Equation)和米-曼常数Km(Michaelis-Menten
Constant)
l913年Leonor
Michaelis和Maud L.Menten基于下列假设,推导出米-曼方程式,它表示底物浓度[s]变化对酶促反应初始速率(V)影响的方程式(方程式推导从略)。
这些假设是:(1)单底物反应;(2)测定的反应速率是初始速率(initial rate),困为反应刚刚开始,生成产物量极少,产物的逆反应可忽略不计;(3)在反应起始时,底物浓度[S]远远大于酶浓度[E],[S]变化可以忽略不计。
![]()
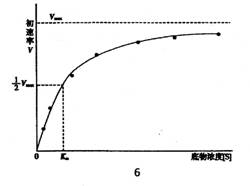
V-不同底物浓度[S]时的初始速率
Vmax ——最大初始反应速率
Km ——米-曼常数,是初始速率V为1/2 Vmax时的底物浓度[S]。
Kl、K2、k3分别为酶E和底物S生成复合物ES、复合物的逆反应和复合物分解生成产物和游离酶的三个速率常数
从米-曼方程式可推论出:
l、当底物浓度[S很低时,如[S]<<Km,式中分母Km+[S]≌Km,则V=Vmax/Km,反应速率V与[S]成正比(一级反应,呈线性相关);
2、如底物浓度[S]很高,且[S]>>Km,Km+[S]≌[S],则V≌Vmax,这时所有酶分子中的活性部位均被底物饱和。
3、当V=1/2
Vmax,代入方程式,得Km=[S],即表示当反应速率为最大速率的一半时,米-曼常数Km值等于底物浓度[S]。
(2)米曼常数(Km)
米-曼常数(Km)是酶的特征常数。在一定反应条件(温度、pH和离子强度)下,它只与酶的种类和底物的性质有关,与酶的浓度无关。
如酶能催化几种不同的底物,对每种底物都有一个特定的Km值,其中Km值最小的称该酶的最适底物。Km值小,要达到反应速率为最大速率的一半时,所需的底物浓度[S]就低。
当复合物ES离解成E和S的速率K2远远大于ES分解成游离酶E和产物P的速率k3时,即K2>>K3,K2+Κ3≡Κ2,则
|
Km= |
|
= |
复合物ES离解成E和S的速率常数 |
=Ks(离解常数) |
|
K1 |
酶和底物生成复合物ES的速率常数 |
此时Km表征酶与底物的亲合力。但实际上,不是所有的酶促反应中,永远是k2>>k3,所以Km和Ks(离解常数)不是同一个函义,不能相互取代使用。
Km值越大,酶与底物亲合力越小,要达到最大速率的一半时所需底物浓度[S]越高:反之, Km值越小,酶与底物亲合力越大,则要达到最大速率的一半时所需底物浓度[S]低。不同种类的酶,对特定的底物,有不同的Km值。对于一种未知的酶,可在规定的条件下测定其Km值加以鉴定。
(3)用作图法测定求得酶的Vmax和Km值,如图八所示
1、米-方程式曲线
|
|
|
图八 |
如图八所示,米-曼方程式的曲线由三部分组成:
第一部分:起始反应时的直线部分。此时反应速率和底物浓度[S]成正比,反应属一级反应。
第二部分:提高底物浓度,使酶分子的活性部位逐步底物占有,图形中部呈曲线,此时反应属混合级反应。
第三部分:当底物浓度很高,使所有的酶分子的活性部位均被底物占有和饱和。此时,再增加底物浓度,反应速率保持不变,成渐近线,反应属零级反应。
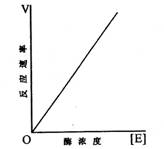
2、Lineweaveer-Burg(简称林-贝)双倒数法(double reciprocal plot)作图求Km值和Vmax。
理论上,可以用多种方法测定米-曼常数Km和Vmax值。例如,在反应中固定酶的浓度,测定在不同底物浓度下的初始反应速率,求得Km和Vmax值。但是由于米-曼方程式曲线在接近Vmax时是渐近过程,很难测得真实的Vmax,所以不能直接用起始速率对底物浓度作图来求得Km或Vmax值。
1930年Lineweaver和Burk把米-曼方程式两边取倒数,即得下式。此式表示1/V和1/[S]呈直线关系,式中,Km/Vmax是斜率,1/Vmax是y轴上的截距。
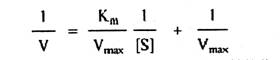
将1/V对l/[S]作图,即可得到一条直线。该直线在Y轴的截距为1/Vmax,在X轴上的截距为-1/Km的绝对值(如图九所示)。
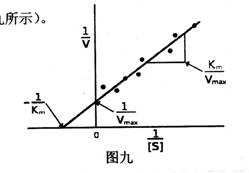
(二)在底物浓度足够大时,反应速率随酶浓度提高而呈直线增加
当反应体系中,底物浓度很高,且大大超过酶浓度,酶分子中所有活性部位都与底物生成复合物ES,且被底物饱和时,反应速率(V=K3[ES]=K3[E])达到最大值Vmax。此时,反应属一级反应,即反应速率与酶浓度增加成正比的直线关系,如图十所示。
|
|
|
图十 酶浓度对速率作图 |
三)温度对酶促反应速率影响的双重性
酶是生物催化剂,温度对酶促反应有双重影响。升高温度一方面可以加怏酶促反应速率。但是,因为大多数酶是蛋白质大分子,常态下,因分子链中各种基团的相互吸引,使酶蛋白构象呈稳定的“线团”状,而活性中心就在其线团的凹穴表面。提高温度会破坏基团间的相互吸引,严重时会使酶变性失活,所以过分提高温度反会使酶变性失活,并不可逆转。
大多数酶在温度
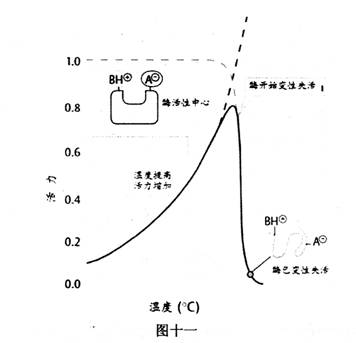
酶的最适温度不是酶的特性常数,因为它随反应进行的时间有关。酶可以在较短时间内承受较高的温度。相反,随着反应时间延长,最适反应温度也会降低。低温虽会降低酶的活性,但不会破坏酶,在温度回升后,酶的活性又会恢复。
(四)pH对酶促反应速率的影响
酶蛋白是两性的高分子电解质,在不同pH条件下,酶分子的酸性基团和碱性基团将发生不同的离解〈特别是处于活性中心的基团),只有当这些基团处于一定的离解状态下,才对底物有最大的亲和力。同时pH也会改变某些底物(蛋白质、氨基酸等)和辅酶的离解程度,从而影响它们与酶和底物的结合。
大多数酶的活力都会受环境pH的影响。只有在某一pH时,酶的反应速率最大,这是酶的最适pH(optimum
pH)。高于或低于此pH,反应速率下降。如图十二所示
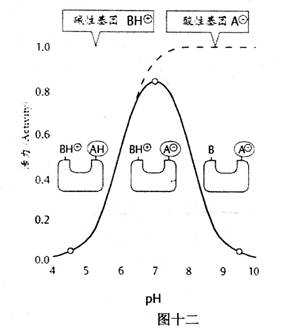
最适pH会随底物种类、浓度和缓冲体系不同而不同,而且常与酶的等电点不一致。因此最适pH不是酶的特征常数,只有在一定条件下才有意义。pH过低或过高都会影响酶的构象,甚至导致酶的变性和失活。
(五)抑制剂和激活剂对反应速度的影咱
(1)抑制剂
一些能与酶的必需基团相结合,从而抑制酶的催化活性但不引起酶蛋白变性的物质统称为酶的抑制剂(inhibitor)。根据抑制剂与酶活性中心的必需基团结合的紧密程度,抑制剂分为不可逆性抑制(irreversible inhibition)和可逆性抑制作用(reversible
inhibition)
1)、不可逆性抑制(irreversible inhhibiton)
抑制剂与酶活性中心的必需基团共价结合, 使酶失活,且此抑制剂不能用透析、超滤等方法予以去除。
2)、可逆性抑制作用(reversible inhibition)
这类抑制剂通常以非共价与酶和(或)酶-底物复合物可逆性结合,使酶活性降低或消失。采用透析或超滤的方法可将抑制剂除去。这类可逆性抑制作用又可分为三种类型:竞争性抑制作用、非竞争性抑制作用和反竞争性抑制作用。
(2)、激活剂(activator)
能使无活性酶转变为有活性或使酶活性增加的物质称为酶的激活剂。激活剂大多为金属离子,如Mg2+,K+,Mn2+等,少数为阴离子,如Cl-等。也有许多有机化合物激活剂,如胆汁酸盐等。激活剂对酶的作用有一定选择性,按其对酶促反应的需要程度,激活剂又可分为必需激活剂(essential activator)和非必需激活剂 (non-essential activator)
2、蛋白质结构图
3)20种氨基酸
主要参考资料
[1]Color
Atlas of Biochemistry ,.2nd.Ed.(J.koolman,K.H.Roehm)(Thleme,2005)p88-110
[2]Lehninger Principles of Biochemistry.(4-edition》p190-237
[3]王镜岩 生物化学(第三版);31-429
[4]查锡良 生物化学(第七版);64-85
[5]豆丁网:有关“酶化学”资料http://www.docin.com/app/docsearch?fn=&searchType_banner
=p&dky=%E9%85%86%E5%
[6]维基百科“酶”(WikipediaCategory:Enzymes) http://en.wikipedia.org/wiki/Category:Enzymes