碱性果胶酶菌种选育及在纺织前处理中的应用研究yd12006
吴茜 沈雪亮 汪钊 浙江工业大学生物与环境工程学院,浙江杭州310014
原载:第八届全国染整前处理学术研讨会论文集(2009);352-354
【摘要】从土壤及腐败的水果中筛选到一株产碱性果胶酶酶活高的菌株,经过初步鉴定为芽孢杆菌属,命名为Bacillus sp.WZ008,经发酵,酶活可达到42
U/mL,酶的最适作用条件为pH值9.6,
【关键词】碱性果胶酶;芽孢杆菌:织物:前处理
果胶酶是一类能分解植物组织中果胶质的酶系,碱性果胶酶是指在碱性范围内具有较高活性的果胶酶,目前广泛用于织物处理、植物纤维脱胶、造纸、纯化植物病毒等方面[1]。传统的棉织物精练加工是在高温、强碱条件下进行的,既不利于环保,对织物损伤也较大.而用碱性果胶酶处理织物。由于酶的专一性且作用条件温和,具有对织物损伤小,对环境污染少的优点.碱性果胶酶可由细菌、放线菌、真菌产生,但具有工业化应用前景的菌种并不多,仅有嗜碱芽孢杆菌[2]、螺胞菌[3]等几种。本试验从土壤及腐败的水果中分离筛选到了一株碱性果胶酶的高产菌株,初步考察了自制碱性果胶酶在纱布精练加工中的应用效果。
1 试验
1.1 试剂
果胶(pectin),Sigma公司:纱布,上海川本卫生材料有限公司秀洲分公司;其余试剂均为国产分析纯。
1.2 培养基组成
富集培养基:桔皮粉
1.3 菌种筛选
富集培养:将从湖北、浙江各地果园中选取的适量土壤放入盛有无菌生理盐水带玻璃珠的三角烧瓶中制成土壤悬液.将一些含果胶质高的腐败水果表皮以及土壤悬液分别放入富集培养基中,
复筛:将初筛得到的菌株接种到种子瓶,用250ml三角瓶装30mL培养基,
1.4 织物处理工艺
酶精练:沸水预处理30 min[4]→酶精练(
1.5 分析方法
酶活测定:取1mL适当稀释的粗酶液和2~ml l%(质量分数)果胶溶液(pH9.6)分别置于两个试管中,于
2 结果与讨论
2.1 菌种筛选与鉴定
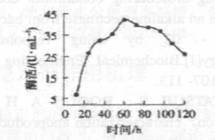
菌种筛选:从多份土壤以及腐败的水果中选择圈径比大的菌落,初筛到19株细菌、2株霉菌.通过复筛,筛选到一株产酶较高的细菌。菌种鉴定:筛选到的菌株培养24h后,菌落呈乳白色,圆形,显微镜下观察为杆状.革兰氏染色为阳性,有芽孢,大部分为中生。根据<伯杰氏系统细菌学手册>描述特征,该菌株属于芽孢杆菌,暂定名为Bacillussp.WZ008.摇瓶产酶:将种子液以10%(体积分数)的接种量接入到发酵培养基中,用500
mL三角瓶装30 mL培养基,
|
|
|
图1碱性果胶酶产酶进程 |
2.2 酶学性质
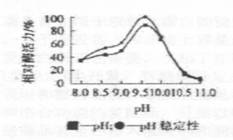
2.2.1 最适作用pH及pH稳定性
将酶液分别加入到用pH 8.0-10.6的甘氨酸,氢氧化钠缓冲液、pH 11.0的磷酸氢二钠,氢氧化钠缓冲液配制的果胶溶液中,测定酶活力。图2结果表明:此酶的最适pH为9.6.将酶在不同缓冲体系中
|
|
|
图2酶的最适作用pH及pH稳定性 |
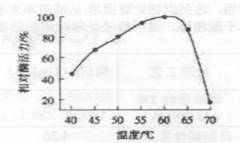
2.2.2 最适作用温度及温度稳定性
图3结果表明,酶的最适作用温度为
|
|
|
图3酶的最适作用温度 |
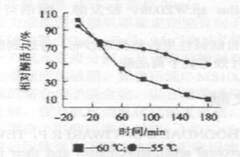
由于碱性果胶酶在纺织前处理工艺中的反应时间一般在lh左右,因此,研究酶的热稳定性就显得非常重要.在
|
|
|
图4酶在 |
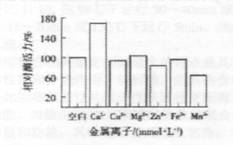
2.2.3金属离子对酶活力的影响
各种金属离子对碱性果胶酶酶活的影响见图5。
|
|
|
金属离子mmol/L |
在酶反应体系中分别加入CaCl2、MgS04·7H20,CuS04,ZnCl2,FeSO4·7H20,MnCl2·4H20,使其最终浓度为lmmol/L,考察它们对酶活力的影响.图5结果表明,Ca2+对酶活有明显的促进作用,Mn2+对酶活有一定的抑制作用,其他金属离子对酶活没有明显影响.碱性果胶酶需要Ca2+作为激活剂,研究碱性果胶酶结构时发现有Ca2+的结合位点。[6]
2.3 织物处理
由表l可以看出,从毛效与织物上裂解的不饱和聚半乳糖醛酸量两个指标来看,酶精练与碱精练效果相当,达到织物处理要求.从减重率来看,酶精练要低于碱精练,说明酶法处理对织物的损伤小。从手感来讲,酶精练的柔软度也优于碱精练。
表1 酶精练与碱精练效果对比
|
处理工艺 |
酶活 (Um/L) |
减重率 % |
毛效 /cm/(30min) |
A /(μmol/g) |
|
诺维信酶2%(体积分数) |
3.75 |
1.16 |
7.5 |
3.99 |
|
自制碱性果胶酶 |
4.26 |
1.59 |
8.0 |
5.44 |
|
碱精练 |
|
3.27 |
7.3 |
4.79 |
注:A为织物上裂解的不饱和聚半乳糖醛酸量。
用自制碱性果胶酶处理的织物,其润湿性、果胶去除量均略优于诺维信酶.说明自制碱性果胶酶可以代替诺维信酶用于棉织物处理。
3 结论
(1)从土壤及腐败的水果中筛选到一株产碱性果胶酶酶活高的菌株,经初步鉴定为芽孢杆菌属,命名为Bacillus
sp.WZ008。经发酵,酶活可达到42U/mL.。
(2)用自制碱性果胶酶处理纱布,可达到织物处理要求,且效果优于商品酶.
参考文献
[1]
H00NDAL G S,TTYWARI R P,TEWARIR,et a1.Microbial alkalinepectionases and their
industrial applications:a review[J]App1.Microbi01.Biotechno1.,2002,59:409-418.
[2]
[3]钟卫鸿,王启军,岑沛霖.螺胞菌ZC0901的筛选及其产碱性果胶酶发酵条件研究[J]应用与环境生物学报,2000.6(5):468-472
[4]WANG
Q,FAN Xue-Rong,HUA Z Z,et a1,Optimizing bioscoming conditionof cotton knitted
fabrics with an alkaline pectinase from bacillussubfilis WSHb04.02 by using
response surface Method ology[J].Biochemical Engineering Journal,2007,34:107.113.
[5]TATSUJI S,ROQUE A H,TAKUO S.Purification,characterization
and production of two pectic transeliminases with
photopectinase activity from bacillus subtilis[J].Biosci.Biotech,Biochen,1994,58:353.358.
[6]HERRON,RICHARD
S.A sturtural and kinetic understanding of theenzymatic mechanism of the
pectate lyases[D].Irvine:University of California,2001.