葡萄糖氧化酶的棉织物酶漂白yd10115
原载:全国染整新技术协作网简讯2008/6;1-8
一、前言
漂白是染色织物必不可少的前处理工序,目前棉织物最常用的漂白剂是H202,漂白是在沸腾的矸性条件下进行的。由于对棉纤维中色素的结构、组成以及其粘附情况尚不完全明白。通用的漂白剂H202是非常有效的,然而,由于漂白所需的碱性条件,在漂白后又要用大量的水进行清洗,并且H202的白由基反应会对纤维素造成损伤,特别是当有金属离子存在时更为严重[31]
具有漂白作用,无毒和对环境发好的酶制剂,它们已经在纺织品、纸浆及造纸工业中进行过试验的有三种,可供选择:过氧化物酶,漆酶/传递介质体系和葡萄糖氧化酶。一般而论,这三种酶的作用是属于完全不同体系的。
在其它具有催化功能的酶制剂中,过氧化物酶可以促进氧化剂,诸如H202的反应[9]。或用山葵(辣根) (horseradish),锰和木质素过氧化物酶漂白木质纸浆已有成功报告[27]。Chen和Chang[8]以及Kirk和Shiamda[15]广泛地探讨过氧化物酶对木质素的生物降解和解聚过程中的化学和生物化学反应。与锰过氧化酶合用可以提高纸浆的亮度[21]。山葵过氧化酶已成功地应用于消除有色纸浆和棉织物加工厂废水的脱色,以及防止洗涤时的沾色[20]。然而,应用过氧化物酶漂白棉织物的报告却很少[24]。
漆酶是一类相当不专一性的酶,它能使有色化合物的发色基团切断。由于其作用不专一性的特征,所以必须使用有机传递介质化合物。传递介质可以在酶的活化中心和基质的一定距离之间传递电子。漆酶和锰过氧化酶混合已经应用于含木质素纤维,诸如:洋麻(Kenaf)和亚麻(Flax)处理[25]。Cavaco-Paulo等[7]人报告称:用漆酶作纺织染料的脱色,以及建议以一个酶的体系用于靛蓝染色织物的漂白。固定在海藻酸珠子里的漆酶,可以提高纸浆和纺织工厂的废水中颜色的去除;尽管其效率比过氧化物酶稍差[10]。漆酶已成功应用于牛仔布的靛蓝漂白[11,30]。
葡萄糖氧化酶(GOD)是黄素蛋白质(Flavoproteins),具有一个黄素腺嘌呤二核苷酸(FAD.Flavin-adenine-dinucleotide)活化中心,它对β-D葡萄糖有高度专一性,能在PH4.5-7和温度接近40℃时,催化生成H202反应式如下:
β-D-葡萄糖+GOD-FAD←→GOD-FADH2+õ-D-葡萄糖酸内酯
GOD-FADH+02→GOD-FAD+H202
当有水存在时,õ-D-葡萄糖酸内酯形成葡萄糖酸,它是H202漂白时的良好螫合剂,如果织物漂白所用H202是用葡萄糖氧化酶生产的,在微酸性到中性条件下,其所需的温度也很低,完全可以避免酶的失活。然而,在这样的条件下,H202的漂白效果无论如何是没有意义的。
其它有人建议,在葡萄糖氧化酶的处方中加入洗涤剂以加强去污能力,防止洗涤时染料再沉积上去[1,14,22,26],以及洗碗盆时防止食物再沾污塑料盛器[19],关于葡萄糖氧化酶用于棉织物湿处理的报告极少,少数日本出版物和专利曾述及是成功的处理方法[11,13,18]。
Schacht等人在发现过氧化物酶不适宜用作漂白后,曾报导称:将含淀粉化合物的酶退浆液与葡萄糖氧化酶联合使用产生H202。其它工业上的应用,葡萄糖氧化酶与过氧化物酶合用可漂白角蛋白(Keratin)纤维[16]。
我们研究的一个主要方面,是研究如何才能使酶退浆和生物煮练的废液能应用于酶漂白。本文在生物煮练时以果胶酶为主,试验了添加或不添加纤维素酶;在酶漂白是如何利用煮练过程产生的葡萄糖供葡萄糖氧化酶进行生物漂白,生物煮练应用纤维素酶以外的混合酶,发表于其它文献[4,29]。处理液的回用以及将独立的三个工序合而为一,可达到节约成本的目的。
二、 实验
100%平纹棉织物由试验织物公司(testfabrics.Inc.NJ)提供,本实验是用400R(印花坯布),400U(经退浆,但未经漂白的印花半制品)和400(经退浆和漂白印花半制品作对比样),纱的支数是24/24(经/纬),织物单位面积重量为119.6g/m2,所有试样尺寸为20×15cm。
实验所用果胶酶(由Aspergillus niger制得),Cellusoft L, Cellulase是Novo Nordisk赠予,果胶酶(Pectinase PS由Aspergillus Niger制得,25µ/mg蛋白质),葡萄糖氧化酶( 由Aspergillus Niger制得,332µ/mg蛋白质,简称GOD),淀粉葡萄糖酶(由Aspergillus Niger,制得,6000µ/mg蛋白质),葡萄糖购自Sigma Chemicals。低泡非离子表面活性剂 DA-SP8(主要成分为烷氧基化合物),取自Chemax.Inc.Prestogen SP(H202活化剂)来自BASF,H202(34-37.4%)来自Fisher Chemicals,所有其它化学品均为试剂级。
(一) 方法:
酶退浆:用淀粉葡萄糖酶(Amylogluo sidase)根据生产商提供的试验条件为:PH4.5 (O.05M NaAC水溶液缓冲液),55℃,剂量7µ/ml,浴比20:l;酶失活的方法:将试样浸 于80℃蒸馏水中lO分钟,而后以冷水冲洗、晾干。
生物煮练:用果胶酶(Pectinase PN)2g/L,50℃,pH5.0处理3小时,浴比20:l,以 80℃蒸馏水使之失活。Pectinse PS(12µ/g owf)应用条件为pH4.5,40℃,在同一浴比中处理不同时间。Cellusoft L Cellulase (2g/L)加于煮练液内,以促进试样的吸收性。果胶酶与纤维素酶的应用条件是兼容的。在部分实验中,加入0.O1-0.025%非离子表面活性剂。所有处理均在Laundro Meter(Atlas)耐洗机上以42rpm转速下进行的,酶的失活条件为80℃蒸馏水中处理1O分钟。
退浆和煮练合并:不同剂量的淀粉葡萄糖酶和pectinase。PN(2g/L),pH5.0,50℃处理2小时,浴比20:l(另有说明的例外),Cellusoft L(2g/L)加于部分试验,在试验结果中注明。
酶漂白:葡萄糖氧化酶产生H202的条件是:35℃ 和pH5.1(NaAC缓冲)如条件变化在讨论中另行说明。试验了处理时间的变化,以及葡萄糖和葡萄糖氧化酶浓度的变化,部分试验中加入l0g/L的prestogen SP作为H202活化剂。应用退浆和煮练液的试验,需经冷却至室温,过滤或离心脱水和PH调节。而实际的漂白过程包括二个步骤(除另有说明的),第一步是在酶的优化条件下产生H202,第二步将pH调节至7,在85-90℃ 处理60-120分钟,由酶产生的H202进行漂白。
碱煮练和通用H202漂白:为了比较起见,坯布采用常规的煮练和漂白生产工艺,都是在Laundro-Meter(Atlas)耐洗机上,以转速为42rpm条件下进行。而通常煮练浴处理时是没有机械搅拌装置的,如在40%NaOH溶液中,浴比为50:1,在大气压下沸煮90分钟[3]。碱性漂白条件:漂白液由H202浓度为5%(owf,工业品),1%NaOH,0.8%Na2CO3,3%Na2SiO3和0.1%MgSO4组成,浴比为10:l,温度80-95℃,织物在Laundro-Meter(Atlas)耐洗机上转速为42rpm处理l小时。而后用10%HAC溶液中和和用蒸馏水洗涤。
可变的条件:在部分试验中,添加10g/L Prestogen,SP作为H202的活化剂,在中性条件下进行漂白,漂白液由5%H202 (工业品)和0.025%低泡非离子表面活性剂DA-5P8组成,95℃ 漂白2小时。
(二)试样的性能评估
试样数量尺寸按AATCC97-1995要求。织物煮练后果胶质残量测定,按文献l7的Ruthenium Red沾色法。漂白液中H202浓度按AATCC试验法102-1992测定。葡萄糖浓度按Raabo和Terkildsen两氏的方法测定[23]。织物的吸水性按AATCC试验法79测定。试样的白度,由Data Color分光光度计测定,白度指数(WI)按下式计算。
WI=Y+800(Χn-Χ)+1700(Уn-У)
其中,WI为试样的白度指数;Y,Χ,У分别为试样色度的坐标值;Χn和Уn为在标准光源D65时的读数。试样的断裂强力和断裂引长按ASTM D5053-90(Strip Test)在Instron强力试验机1100型上测定。聚合度按DIN54270,由酒石酸铁钠(FeTNa)溶液作为纤维素溶剂,如早期文献所述[5]。
三、结果与讨论
(一)建立有效的漂白条件
在纺织品的湿加工过程中,H202漂白有活化剂及稳定剂存在时,应用条件为pH l0.5或以上。首先是应用工业品的H202,我们要建立过渡到条件温和的酶漂白。有多种漂白活化剂,诸如硫酸镁、水玻璃及尿素等可加入缓冲至pH7的漂白溶液中,使坯布的白度能提高到50而巳。要更高的白度可加入Prestogen SP和少量的非离子表面活性剂,在这种情况下,白度指数可达66-70,接近于常规煮练和漂白棉布对比样的水平(72-74)。
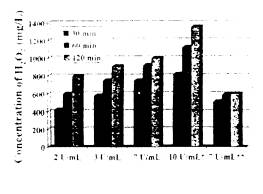
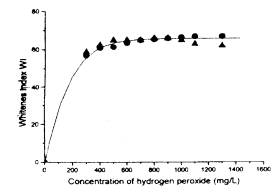
用葡萄糖氧化酶漂白,问题是建立一个合适的平台,需要多少数量的葡萄糖能使葡萄糖氧化酶产生足够的H202,并保持过程的经济性。图l是不同剂量的葡萄糖和葡萄糖氧化酶,在不同反应时间内产生H202量的相互关系。图2是工业品H202及酶法产生的H202,在pH=7和温度90℃时,漂白60分钟后能达到的白度水平。
|
|
|
|
图1 葡萄糖为5g/L,不同GOP剂量 和反应时间产生的H202, *为10%,**为3g/L) |
图2 达到的白度指数 (●)是工业品H202, (▲)是酶法产生的H202浓度 |
由图2可知,漂白液中活化H2O2浓度达到500-800mg/L时,白度指数可达64-65。有兴趣的,当酶生产的H2O2浓度再继续提高时,白度指数反而会稍有下降。这可能是由同时生成的葡萄糖酸浓度也相应提高之故。因它是良好的稳定剂,使漂液过份稳定之故。
如葡萄糖浓度很低时(如图l的3g/L),漂白液中活化H2O2浓度很难达到500-600mg/L,此时即使反应时间再延长也无济于事。而葡萄糖浓度为5g/L时,而葡萄糖氧化酶浓度在3µ-7µ/mL之间,就很容易达到目标,只需处理30-60分钟即可。更多的葡萄糖和葡萄糖氧化酶都是不必要也是不经济的。如葡萄糖浓度不变,而葡萄糖氧化酶浓度降低,则可将处理时间需延长至90分钟。
(二)酶退浆和生物煮练液作为葡萄糖氧化酶所需葡萄糖来源,酶退浆和生物煮练液的回用,存在着一些挑战。首先,是增强了污染,尤其是煮练后的废液,这些污染物可能重新沉积在棉布上。此外,在漂白过程中,似乎有一部分H2O2是多损耗的。因为漂白织物时,溶液中溶解的和不溶解的污染物也漂白的。其次,在漂白液中不仅仅是由前工序生产的葡萄糖的数量问题,并且还存在具有抑制作用的未失活的酶制剂和葡萄糖以外的其它糖类。
最初,只用退浆液,其中仍有活性淀粉葡萄糖酶直接用于葡萄糖氧化酶生产H2O2。其优点是污染较轻,葡萄糖平均浓度为3900mg/L,加入葡萄糖氧化酶(4 µ/mL)于35℃ 时,15分钟内可生产620mg/L的H2O2,如经加热使淀粉酶失活,并不会影响其结果,仍可生产相同数量的H2O2,但是,处理后的织物的吸水性达不到要求了。
其次,我们将退浆和煮练混合后进行,中间不经酶的失活处理,用Pectinase PN及Cellusoft L于pH5.0温度50℃,处理时间延长至2小时,目的是以补偿由于杂质增加而引起的一些副作用(Side Effects)的影响,葡萄糖生产量达4050mg/L,但葡萄糖氧化酶所产生的H2O2却只有130mg/L。这一数量明显偏低。现在的问题是:到底是两者或者只是煮练酶干扰了葡萄糖氧化酶的活性,以及是那种反应生成物的影响。
而单独用Pectinase PN试验,在葡萄糖含量为4075mg/L时,H2O2的生成量仍只有140mg/L,并没有明显的提高;而用淀粉葡萄糖酶和纤维素酶混合的,葡萄糖含量4100mg,/L时,可以生成715mg/L H2O2。因而,显然是淀粉葡萄糖酶和纤维素酶混用对生产葡萄糖十分有利的,然而,其缺点是吸水性差。
通过对果胶酶失活处理后,虽然处理液中的葡萄糖只有3975mg/L,仍能生产出705mg/L的H2O2。这一事实说明:由于葡萄糖氧化酶对β-D-葡萄糖的高度专一性,并不会受到处理液中与葡萄糖同时生成的其它各种糖的影响。很显然,这种情况并不是处理液中葡萄糖含量也不是酶失活所致。如果以Pectinase PS取代Pectinase PN,也可产生相当数量的葡萄糖和也不需要失活处理的。因而,我们认为Pectinase PN中存在少量杂质,可能是少量的过氧化氢酸(Catalase),因而当有少量活性果胶酶存在就会减少H2O2的产量。
表1的数据显示了酶退浆和酶退浆与煮练联合处理时,不同PH值和温度变化,以及失活后由葡萄糖氧化酶产生的H2O2量。当活化H2O2浓度超过500mg/L时,试样的白度指数约为63-65(如图2所示)。而退浆后棉布的吸水性是不够;退浆与煮练联合处理,在PH5和50℃的试样吸水性较好。试样的失重也没有显著不同,加入纤维素酶的试样、手感较柔软,用流行的川端(Kawabata)手感法评价也是后者为好。
表l不同条件的退浆(3小时)和退浆煮练(2小时)的H2O2生成量与棉布的失重和吸水性(与空白对照)
|
处理条件 |
葡萄糖mg/L |
H202 Mg/L |
吸水性(秒) |
失重% |
|
|
PH4.5; 50-55℃ |
退浆 |
3995±15 |
600±5 |
2180 |
9.92±0.06 |
|
退浆和煮练 |
4031±56 |
685±25 |
50 |
12.65±0.83 |
|
|
pH4.75-5.0; 52.5-55℃ |
退浆 |
4070±50 |
610±0 |
2180 |
9.58±0.23 |
|
退浆和煮练 |
4106±28 |
669±6 |
57 |
12.06±0.10 |
|
|
pH5.0; 50℃ |
退浆 |
3965±15 |
608±12 |
2180 |
9.8l±0.02 |
|
退浆和煮练 |
4000±25 |
718±13 |
16 |
12.47±0.25 |
|
淀粉葡萄糖浓度20µ/g(owf) 浴比20:1
Pectinase PN浓度2g/L 葡萄糖氧化酶浓度4µ/ml
Cellusoft L浓度2g/L 处理强度35℃ ,时间45分钟
(三)处理织物的断裂强力和聚合度:
经常规煮练和而后的H2O2漂白,会导致织物的断裂强力明显的下降,特别是煮练时存在氧气,或H2O2漂白时有重金属离子如Fe,Mn等[31]。因此,必须小心控制这些工艺过程,以保证加工织物强力。在纤维上如发生游离基反应,会导致聚合度下降,而影响织物的物理性能。
表2的数据显示在常规煮练和漂白的过程中,会严重影响处理织物的聚合度,纺织品的断裂强力与聚合度没有直接的关系(见表3)。聚合度下降所引起的问题往往要在后续加工或最终使用过程中才能反映出来。
表2常规的和酶前处理对棉织物聚合度的影响(平均数,与对照样标准差)
|
处理条件 |
聚合度(DP) |
|
|
常规 工艺 |
棉坯布(未经处理) |
3850(±95) |
|
退浆后(未经漂白) |
3700(±60) |
|
|
退浆及漂白后 |
1450(±30) |
|
|
碱煮练后* |
2800(±50) |
|
|
碱煮练及H202漂白后 |
1 100(±60) |
|
|
酶处理 工艺 |
酶退浆后 |
375G(±60) |
|
酶煮练后(Pectin£Lse PN,Cellusofl L) |
4300(±50) |
|
|
退浆、煮练.浴处理 (Pectrinase PN,Cellusofl L |
4400(±40) |
|
|
退浆、煮练+碱处理** (用矸液沸煮3分钟,提高吸水性) |
4000(±20) |
|
|
退浆、煮练+GOD漂白*** (二步法) |
3750(±40) |
|
注:*条件如前述
**为了改进吸水性和工艺效果,在淡溶液中沸煮3分钟
***二步法漂白添加表面活性剂,浴比10:l,pH7.0
表3 未处理和处理试样的断裂强力(纬向,平均值,与对照样标准差)
|
处理条件 |
断裂强力(kg) |
|
坯布(未经处理) |
25(±2.4) |
|
常规退浆后(未漂白) |
24.8(±2-2) |
|
常规退浆及漂白后 |
24.3(±1.2) |
|
常规碱煮练后 |
23.5(±2.5) |
|
常规碱煮练及漂白(H202)后* |
20.4(±1.9) |
|
缓冲处理后 |
24.2(±2.O) |
|
酶退浆后 |
23.6(±2.2) |
|
酶煮练后(Pectinase PN) |
22.O(±2.5) |
|
一浴法酶退浆煮练 (Pectinase PN,Cellusoft L) |
18.5(±3.6) |
|
同上+ 碱处理** |
18.7(±2.1) |
|
同上+ GOD漂白*** |
16.3(±2.4) |
注:*、**、***说明同表2
酶退浆是不会影响聚合度的,如果仅仅用果胶酶煮练也不会影响聚合度。这些酶制剂只对非纤维素杂质反应,不会涉及纤维素链段。酶处理织物的聚合度没有影响,要比常规处理的高得多。表2中酶退浆煮练一浴法试样的处理条件是pH5.O,温度为50℃。
表3是相对应的试样的断裂强力数据。显然聚合度的下降并没有立刻反映其断裂强力随之降低。在这个阶段,即使常规处理试样的聚合度降低到相当低水平,其强度仍无大影响。在实验室小试样上,经碱煮练和H202处理后,其断裂强力下降约18%。
酶退浆不会显著影响其断裂负荷(23.6kg),然而,用Pectinase PN煮练测试样的断裂强力会有所下降,如添加Cellusoft L后,则对断裂强力会有较大的损伤。我们认为:纤维素酶是强力下降的主要根源,这可能是Pectinase PN确实含有少量纤维素酶的杂质,以致具有相似的效果。纤维素酶单独处理,强力下降约为25%(139.3kg)其聚合度却没有明显变化。产生上述的情况,是由含纤维素酶混合物的水解,是一种从纤维素分子链末端开始的外切作用所致[6]。然而,不论任何材料用含纤维素酶混合物处理后,会有柔软和舒服手感性能的优点。
(四)酶煮练工艺的改进
由于观察到强力损失过大,我们改进了酶煮练工艺,采用一种不含或极少含有纤维素酶杂质的果胶酶(Pectinase
SP),并且取消了与Cellusoft L的混用,同时加入很低浓度的非离子表面活性剂,PH保持4.5,温度控制为40℃,处理60分钟。应用这种果胶酶,特别是添加非离子表面活性剂的试样其吸水性有明显改善(<4秒),而强力基本上保持不变,平均值为23.3±2.4kg,且与果胶酶的浓度无关。Pectinase
PS的用量为6µ/g和12µ/g时,织物煮练后的失重率分别为8.8和9.4%。表面活性剂在酶反应中的作用是有争议的,似乎是表面活性中的某一特殊结构和整个处理条件有关[28]。非离子表面活性剂通常作为润湿剂,有助于酶接近棉织物(基质),这样处理的试样手感尚在评估中。
五、煮练/退浆/漂白的联合处理
将淀粉葡萄糖酶和葡萄糖氧化酶加入改进的酶煮练处理液中处理试样的失重为10-10.6%,而吸水性进一步下降至3-4秒,断裂强力保持不变。为使葡萄糖氧化酶生产的H202量不低于500mg/L,则淀粉葡萄糖酶的用量必须加倍才能保证有足够的葡萄糖。这样可保证试样的白度指数高于63
(见图2),而葡萄糖氧化酶的浓度保持不变,非离子表面活性剂的良好效果也显示出来了。在处理时间的范围 (60-120分钟)内,无明显的差异。联合处理试样的白度指数在62-64之问,最后,试样经短时问矸处理(表2,**试样)能使白度指数提高到73,对强力无明显损失。
四、结论
我们建立的加工方法,是将酶退浆,生物煮炼和由葡萄糖氧化酶进行酶漂白联成一体的,应用水介产物葡萄糖供应葡萄糖氧化酶生产H202,因而实现处理液的回用。生物煮练时,如果添加纤维素酶,试样的各项性能都很好,但是强力损伤较大,还包括众所周知的纤维素酶的对基质降解作用。若以非离子表面活性剂替代纤维素酶,可获得类似的性能而强力可免受损伤。当有淀粉葡萄酶能生产足够的葡萄糖供应时,酶退浆/煮练/漂白一浴法是可行的。酶漂白试样的白度指数接近常规H202漂白织物的水平。酶前处理具有能源成本低,洗涤用水少,为纺织品前处理提供了一个可选择的具有经济效益的途径。
五、参考文献
[1]Andexer,H..and Upadek,H.,Detergents Containing
Enzymic Bleach System Comprising Oxidaseand Substrte、Ger.pat.appl.DE 92-4231767
920923.
[2]Beggs,T.S.,Beggs.M.J..Davis,P.J.,Frenken,L.GJ.,and
Verrips,C.T.,Bleaching Enzymes for Detergents for Laundering Fabrics,PCT
int.appl.Wo 98-EP3438.
[3]Bentley,R.,in”Methods in Enzymology,”Vot.IX.S.Colowick
and N.Kaplan Fds.,Academic Press,NY.1966.P86.
[4]Buschle-Diller,G.,Traore,M.K.,and Yang, X.D.,Bioscouring
and Biobleaching of Cotton,Int.Conf.Adv.Fiber Materials.Ueda Japan,October
l999.
[5]Busdlle.Diller.G.,Inglesby,M.K.,E1-Mogahzy,Y.,and
Zeronian,S.H.,The Effect of Scouring Using Enzymes,Organic Solvents and Caustic
Soda on the Properties of Hydrogen Peroxide Bleached Cotton Yarn.Textile
Res.J.68,920-929(1998).
[6]Buschle-Diller,G.,and Zeronian,S.H.,S.H.,Enzymatic
and Acid Hydrolysis of Mercerized Cotton Cellulose,Textile
Chem.Color.26.17-24(1994).
[7]Cavaco-Paulo,A.,Laccases for Textile Applications,217th
Am.Chem Soc.National Meeting,Anaheim,CA,March 21-25,1999.
[8]Chen,C-L.,and Chang,H-M.,Chemistry of Lignin
Biodegradation. ch,19 in”Biosynthesis and Biodegradation of Wood Components,”T.Higuchi,Ed.,Academic
Press,NY,1985.
[9]Colonna.S.,Gaggero,N..Richelmi,C.,and Pasta P.,Recent
Biotechnological Developments in the Use of Peroxidases,Tibtech.17,163-168(1999).
[10]Davis,S.,and Bums,R.G.,Decolorization of Phenolic
Effluents by Soluble and Immobilized Phenol Oxidases,Appl.Microbio1.Biotechno1.32(6),721-726(1990).
[11]De.P.,Denim Washing and Finishing:A
Revies. Man Made Text.India 41(3).129-131(1998).
[12]Ishihara,A.,Maeshima_Y.,Kino.H.,and Nagasu.Y.,Eco-Friendly
Processing of Cotton Fabrics,Shizuoka-Ken Harnamatsu Kogyo Gijutsu Senia Kenkyu
Hokoku 8,1-6(1998).
[13] Ishihara,A.,Ueta.H.,Maeshima_and Oishi.K.,Enzymatic
Processes for Bleaching Cotton Fabric,Shizuoka-Ken Hamamatsu Kogyo Gijutsu
Senia Kenkyu Hokoku 7,7-13(1997).
[14]Johnston.J.P.,Detergent Composition
Inhibiting Dye Transfer in Washing.Eur.Pat,Appl.,EI’91-202655 911014.
[15]Kirk.T.K.,and Shimada.M.,Lignin Biodegradation;The
Microorganism Involved and the Physiology and Biochemistry of Degradation bv
White-Rot Fungi.ch.2l in”Biosynthesis and Biodegradation of Wood Components.”T.Higuchi.Ed.,Academic
Press,NY,1985.
[16]Kunz,M.,and Le Cruer,D.,Agent and Process
for Oxidative Dyeing of Keratin Fibers,Eur.Pat.appl..EP96-1119343 961203.
[17]Li.Y.,and Hardin,L.R.,Enzymatic Scouring
of Cotton,Texti1e Chem,Color.29,71-77(1997).
[18]Miyasaki.Y.,Shintou.H.,Nishioka.J.,and
Fukano.K.,Liquid Oxygen-Type Bleaching Composition for Textiles.JP 97-126472
970430.
[19]Moens.M.K.C.,Machine Dishwashing Method
Employing a Metallo Catalyst and Enzymic Source of Hydrogen Peroxide.PCTint.Appl.W094-US3l69
940323.
[20]Morita.M.,Ito.R.,Kamidate.T.,and Watanabe,H.Kinetics
of Peroxidase Catalyzed Decoloration of OrangeⅡ、with Hydrogen Peroxide,Textile
Res.J.66,470-473(1996).
[21]Nobuyuki.K.,Tsutsmni.Y.,and Nishida.T.,Correlation
of Brightening with Cumilative Enzyme Activity Related to Lignin Biodegradation
During Birbleaching of Kraft Pulp by White Rot Fungi in the Solid State
Fementation System, Appl.Environ.Microbio1.6l,617-622(1995).
[22]Pramod.K.,Liquid Laundry Detergents
Containing Stabilized Glucose-Glucose Oxidase System for Hydrogen Peroxide
Generation.US pat.92-992326 921221.
[23]Raabo.E.,and Terkildsen.T.C.,On the
Enzymatic Determination of Blood Glucose,Scand.J.Clin.Lab.Invest.12,402(1980).
[24]Schacht.H.,Kesting.W.,and Schollmeyer,E..Prospects
for Enzymatic Processes in Textile Processing.Part 1:New Processes for
Bleaching of Cotton Using Enzymes,TextiNeredlung 30(11/12),237-243(1995).
[25]Sermanni.G.,Giovannozzi.G.,Cappelleto,P.,Baldo.R.,Perani,C.,Porri.A.,and
Dannibale.A.,Production of Cellulose Paper Pulps by Biode lignification of
Vegetable Masses and Apparatus Used The rein,PCT int.Appl.WO 97-EP424 970131.
[26]Thoen.C.A.J.,Fredj.A.,and Labeque,R.,Detergent
Compositions Inhibiting Dye Transfer In Washing,Eur,Pat.Appl.EP 92-870019
920131.
[27]Tien.M.,and Kirk.T.K.,Lignin Degrading Enzyme
from Phanerochate Chrysosporium:Characterization and Catalytic Properties of a
Unique H202-Requiring Oxygenase.Proc.Nat.Acad.Sci.81,2280(1984).
[28]Traore.M.K.,and Buschle-Diller,G.,Influence
of Wetting Agents and Agitation on Enzymatic Hydrolysis of Cotton.TCC ADR
l,51-56(1999).
[29]Traore.M.K.,and Buschle-Diller.G.,Environmentally
Friendly Scouring Processes.AM.Assoc.Text.Chem.
Color.,1999Int.Conf.&
Exhib.,Charlotte,N.C.,October 12-15,1999.
[30]Vollmond.T.,Bleaching and Brightening of
Dyed Textile swith Desired Look and Shades,PCTint.Appl.WO 9725469 A1 19970717.1997
[31]Zemniam.S.H.,and Inglesby.M.K.,Bleaching
of Cellulose by Hydrogen Peroxide,Cellulose 2,265272(1995).
本文译自Gisela Buschle-Diller,et.a1.,”Engymatic
Bleaching of Cotton Fabric with Glucose Oxidase”,Textile Res.J., 2001.7l(5):388/394.王焕祥、杨栋樑译并校