缓释微胶囊药物制造理论与技术yd7009
资料来源:超星电子图书馆藏书\<药剂学>第四版\毕殿洲主编
第八章制剂新技术(P122-139)\陆彬编著
微型包囊是近30年来应用于药物的新工艺、新技术,其制备过程通称微型包囊术(microencapsulation),简称微囊化,系利用天然的或合成的高分子材料(统称为囊材)作为囊膜壁壳(membrane wall),将固态药物或液态药物(统称为囊心物)包裹而成药库型微型胶囊,简称微囊(microcapsule)。也可使药物溶解和(或)分散在高分子材料基质中,形成基质型(matrix type)微小球状实体的固体骨架物称微球(microsphere)。微囊和微球的粒径属微米级,粒径在纳米级的分别称纳米囊和纳米球。本节主要讨论微囊。
(一)药物微囊化的特点
药学的迅猛发展,药物种类日益繁多。仅用原有制剂技术,己不能满足临床要求。因之不断有新工艺、新技术应用于制剂制备过程中。微囊化就是近年药物应用新工艺、新技术中的一个突出代表。已有30多类药物在近年来用微囊化技术,如解热镇痛药、抗生素、多肽、避孕药、维生素、抗癌药以及诊断用药等。上市的微囊化商品有红霉素片(美国)、β胡萝卜素片(瑞士)等。药物微囊化后有以下特点:
(1)掩盖药物的不良气味及口味:如鱼肝油、氯贝丁酯、生物碱类以及磺胺类等;
(2)提高药物的稳定性:如易氧化的β胡萝卜素、对水汽敏感的阿司匹林、易挥发的挥发油类、薄荷脑、水杨酸甲酯、樟脑混合物等药物;
(3)防止药物在胃内失活或减少对胃的刺激性:如尿激酶、红霉素、胰岛素等易在胃内失活,氯化钾、吲哚美辛等刺激胃易引起胃溃疡,微囊化可克服这些缺点;
(4)使液态药物固态化便于应用与贮存:如油类、香料、液晶、脂溶性维生素等;
(5)减少复方药物的配伍变化:如阿司匹林与扑尔敏配伍后可加速阿司匹林的水解,分别包囊后得以改善;
(6)缓释或控释药物:可采用惰性物质、薄膜(惰性的或依赖pH的薄膜)、生物降解材料(或离子透过性不同的材料)、亲水性凝胶等,制成微囊可使药物控释或缓释,再制成控释或缓释制剂.
(7)使药物浓集于靶区:如治疗指数低的药物或细胞毒药物(抗癌药)制成微囊的靶向制剂,可将药物浓集于肝或肺等靶区,提高疗效,降低毒副作用。
(8)可将活细胞或生物活性物质包囊;如胰岛、血红蛋白等,在体内可发挥生物活性作用.且具有良好的生物相容性和稳定性。
值得法意的是,过去花费了巨大财力、人力筛选新药.成百上千极有前途的药物落选.仅因为口服的活性低、或注射的半衰期短。如果采用微囊化这一新技术,药物微囊化后通过非胃肠道给药起缓释作用,许多按过去标准认为不合格的落选药物,可能制成满意的新药。这对新药的开发利用特别有意义。
(二)药物微囊化技术的进展
目前,尽管微囊化的药物制剂商品还不多,但药物微囊化技术的研究却是突飞猛进。
英国出版的Journal of Microencapsulation杂志(季刊)自l 984年创刊以来,到1999年已出第16卷。专业的微囊化国际会议每2年召开一次,1999年9月将在英国伦敦召开第十二次微囊化国际会议.对肽类、蛋白类药物的微囊化,新型生物降解材料的应用,肽类药物的释放,研究微囊结构的新方法,无溶剂的新工艺.固态纳米粒的大规模生产以及多肽微囊、纳米囊用于口服、肺部或非胃肠道粘膜等方面,均有显著进展,这对微囊化研究及应用都起丁很大的促进作用。
微囊化技术的进展可分为几个阶段[22]。 80年代以前主要应用粒径为5µm-2mm的微囊。80年代发展了粒径小(0.0l-10µm)的第二代产品,这类产品通过非胃肠道给药时,被器官或组织吸收能显著延长药效、降低毒性、提高活性和生物利用度.第三代产品主要是纳米级胶体粒子的靶向制剂,即具有持异的吸收和作用部位的制剂,见第十八章。
近年来牛物降解的无毒聚合物开发了一些新用途.通过人工化学栓塞、注射油液或乳剂的淋巴系统导向的肿瘤靶向制剂都已成功。应用影细胞(ghost Cell)或重组细胞(如红细胞)作载体,使生物相容性得以改善,缓释控释避孕药、提高抗体滴度(titer)的抗原微囊化也都实现。临床已将微囊化技术应用于敏感的生物分子,如蛋白质、酶、激素、肽类,甚至应用于活细胞,而不引起活性损失或变性。人工细胞应能模拟细胞的天然功能,既保留原有成分,又可进行与低分子渗透剂的交换反应、这既需要膜较薄、具有半透性,也需要该膜能防止免疫反应或其它引起失活或排斥的反应。这样就可以应用酶、激素甚至生物相容的活细胞进行置换疗法,为纠正组织或细胞功能不全开辟新的途径。已制成微囊化的胰岛,它能保持活力并能在有糖尿病的动物体内长时期不断分泌胰岛素。临床上旱己应用包囊的活性炭的体外循环,对肾衰竭或肝功能失调的病人解毒,人工红细胞在这方面的应用也极有前途。能产生单克隆抗体的杂交细胞,已成功地包囊而应用于生物工程大量生产抗体。
(三)囊心物与囊材
1. 囊心物 微囊的囊心物(Core material)除主药外可以
包括提高微囊化质量而加入附加剂,如稳定剂、稀释剂以及控制释放速率的阻滞剂、促进剂、改善囊膜可塑性的增塑剂等。囊心物可以是固体,也可以是液体。通常将主药与附加剂混匀后微囊化,亦可先将主药单独微囊化,再加入附加剂。若有多种主药,可将其混匀再微褒化,亦可分别微囊化后再混合.这取决于设计要求、药物、囊材和附加剂的性质及工艺条件等。采用不同的工艺条件时,对囊心物也有不同的要求。如用相分离凝聚法时囊心物是易溶的或难溶的均可,而界面缩聚法则要求囊心物必须是水溶性的。另外要注意囊心物与囊材的比例适当,如囊心物过少,易生成无囊心物的空囊。
2.囊材 用于包囊所需的材料称为囊材(Coating material)。对囊材的—般要求是:
①性质稳定,②有适宜的释药速率,③无毒、无刺激性;④能与药物配伍、不影响药物的药理作用及含量测定;⑤有—定的强度及可塑性,能完全包封囊心物⑥具有符合要求的粘度、渗透性、亲水性、溶解性等待性。常用的囊材可分为下述三大类。
(1)天然高分子囊材:天然高分子材料是最常用的囊材,因其稳定、无毒、成膜性好。
1)明胶:明胶是氨基酸与肽交联形成的直链聚合物,通常是Mmw(平均分子量)在15000-25000之间不同分子量的混合物。因制备时水解方法的不同,明胶分酸法明胶(A型)和碱法明胶(B型)。A型明胶的等电点为7-9,10g/L溶液25℃的pH值为3.8-6.0, B型明胶稳定而不易长菌,等电点为4.7-5.0,10g/L溶液25℃的pH值为5-7.4。
两者的成囊性无明显差别,溶液的粘度均在0.2-0.75cPa·s之间,可生物降解,几乎无抗原性,通常可根据药物对酸碱性的要求选用A型或B型,用于制备微囊的用量为20-100g/L。
2)阿拉伯胶:系由糖苷酸及阿拉伯酸的钾、钙、镁盐所组成。一般常与明胶等量配合使用.作囊材的用量为20-100g/L,亦可与白蛋白配合作复合材料。
3)海藻酸盐;系多糖类化合物.常用稀碱从褐藻中提取而得。海藻酸钠可溶于不同温度的水中,不溶于乙醇、乙醚及其它有机溶剂;不同Mmw产品的粘度有差异。可与甲壳素或聚赖氨酸合用作复合材料。因海藻酸钙不溶于水,故海藻酸钠可用CaCl2固化成囊。研究各种灭菌方法对海藻酸盐的影响,高温灭菌(120℃、20分钟)使其10g/L溶液的粘度降低64%,低温加热(80℃、30分钟)几个循环时灭菌效果差,反而促使海藻酸盐逐步断键;用环氧乙烷灭菌也降低粘度和断键;膜滤过除菌的产物粘度和Mmw都不变。
4)壳聚糖:壳聚糖是由甲壳素脱乙酰化后制得的一种天然聚阳离子多糖、可溶于酸或酸性水溶液,无毒、无抗原性,在体内能被溶菌酶等酶解,具有优良的生物降解性和成膜性,在体内可溶胀成水凝胶。
(2)半合成高分子聚材:作囊材的半合成高分子材料多系纤维素衍生物,其特点是毒性小、粘度大、成盐后溶解度增大。
1)羧甲基纤维素盐;按甲基纤维素盐属阴离子型的高分子电解质,如羧甲基纤维素钠(CMC-Na)常与明胶配合作复合囊材,一般分别配1-5g/L,CMC-Na及30g/L明胶,再按体积比2:1混合。CMC-Na遇水溶胀,体积可增大l 0倍,在酸性液中不溶。水溶液粘度大,有抗盐能力和一定的热稳定性.不会发酵,也可以制成铝盐CMC-A1单独作囊材。
2)醋酸纤维素酞酸酯:醋酸纤维素酞酸酯(CAP)在强酸中不溶解,可溶于PH>6的水溶液,分子中合游离羧基,其相对含量决定其水溶液的pH值及能溶解CAP的溶液的最低pH值。用作囊材时可单独使用,用量一船在30g/L左右,也可与明胶配合使用。
3)乙基纤维素:乙基纤维素(EC)的化学稳定性高,适用于多种药物的微囊化,不溶于水、甘油和丙二醇,可溶于乙醇,遇强酸易水解.故对强酸性药物不适宜.
4)甲基纤维素:甲基纤维素(MC)用作微囊囊材的用量为10-30g/L,亦可与明胶、CMC-Na、聚维酮(PVP)等配合作复合囊材。
5)羟丙甲纤维素:羟丙甲纤维素(HPMC)能溶于冷水成为粘性溶液,长期贮存稳定,有表面活性,表面张力(42-56)×105N/cm。
(3)合成高分子囊材:作囊材用的合成高分子材料,有非生物降解的和生物降解的两类。非生物降解.且不受pH值影响的囊材有聚酰胺、硅橡胶等。生物不降解,但可在一定pH条件下溶解的囊材有聚丙烯酸树脂、聚乙烯醇等。近年来,生物降解的材料得到广泛的应用.如聚碳酯、聚氨基酸、聚乳酸(PIA)、丙交酯乙交酯共聚物、聚乳酸-聚乙二醇嵌段共聚物(PLA-PEG)、ε-丙交酯与乙内酯共聚物等,其特点是无毒、成膜性好、化学稳定性高,可用于注射。
聚酯类是迄今研究最多、应用最广的生物降解合成高分子,它们基本上都是羟基酸或其内酯的聚合物。常用的羟基酸是乳酸(1actic acid)和羟基乙酸(g1yco1ic acid)。乳酸缩合得到的聚酯用PLA表示,由羟基乙酸缩合得到的聚酯用PGA表示;由乳酸与羟基乙酸直接缩合的用PLAGA表示。
聚酯特性常用热分析法测定,主要参数是玻璃化温度Tg和晶体熔点Tc(当聚合物有一定程度结晶性时)。热分析可了解载药微囊结构及其变化。
这些聚合物都表现出一定的降解、融蚀的特性。降解是聚合物断键,分子量减小,直至成为单体;融蚀是指分解的小分子脱离了聚合物。结晶度低的降解较快。聚乳酸的Mmw范围在1万-40万,降解周期为2-1 2个月,Mmw=90000的熔点为60℃,在体内6个月降解。有人用聚3-羟基丁酸酯(PHB)为囊材制成胰岛素微囊注射剂,在体内3个月降解。又如消旋丙交酯乙交酯共聚物在共聚时有各种比例,若丙交酯:乙交酯=75:25的共聚物为囊材。在体内1个月可降解,如85:15的为囊材,在体内3个月降解。PLA-PEG嵌段共聚物中PLA为疏水性,PEG为亲水性,调节二者的比例及共聚物的Mr可控制其降解性能,体外降解周期可控制在1-9个月范围内,从而控制微囊中药物的释放速率。
应用高分子附加剂并调整其它微囊化参数,可控制微囊的粘连和聚集.为了控制注射用微囊的质量,达到有关生物相容性的要求.已对人工合成的、多为疏水性的高分子材料作了更为深入的研究。
二、微囊化方法
根据药物和囊材的性质和微囊的粒径、释放性能以及靶向性要求,可选择不同的微囊化方法。可归纳为物理化学法、物理机械法和化学法三大类。
(一)物理化学法
本法微囊化在液相中进行,囊心物与囊材在一定条件下形成新相析出,故又称相分离法(phase separation)。其微囊化步骤大体可分为囊心物的分散、囊材的加入、囊材的沉积和囊材的固化4步。
根据形成新相方法的不同,相分离法又分为单凝聚法、复凝聚法、溶剂-非溶剂法、改变温度法和液中干燥法。相分离工艺现已成为药物微囊化的主要工艺之一,它所用设备简单,高分子材料来源广泛,可将多种类别的药物微囊化。
1.单凝聚法 单凝聚法(simple coacervation)是相分离法中较常用的一种,它是在高分子囊材(如明胶)溶液中加入凝聚剂以降低高分子材料的溶解度而凝聚成囊的方法。
(1)基本原理:如将药物分散在明胶材料溶液中,然后加入凝聚剂(可以是强亲水性电解质硫酸钠或硫酸铵的水溶液,或强亲水性的非电解质如乙醇或丙酮),由于明胶分子水合膜的水分子与凝聚剂结合,使明胶的溶解度降低,分子间形成氢键,最后从溶液中析出而凝聚形成凝聚囊。这种凝聚是可逆的,一旦解除促进凝聚的条件(如加水稀释),就可发生解凝聚,使凝聚囊很快消失。这种可逆性在制备过程中可加以利用,经过几次凝聚与解凝聚,直到凝聚囊形成满意形状为止(可用显微镜观察)。最后再采取措施加以交联固化,使之成为不凝结、不粘连、不可逆的球形微囊。
(2)工艺流程,本法以明胶为囊材的工艺流程如下;
|
|
固体(或液体)药物 |
|
3%-5%明胶溶液 |
|
||||||
|
|
↘↙ |
|
||||||||
|
|
↓ |
|
||||||||
|
|
混悬液(或乳状液) |
|
||||||||
|
50℃ |
↓ |
10%醋酸溶液调至pH3.5-3.8,加60%Na2SO4溶液 |
||||||||
|
|
凝聚囊 |
|
||||||||
|
|
↓ |
加稀释液* |
||||||||
|
|
沉降囊 |
|
||||||||
|
15℃以下 |
↓ |
37%甲醛溶液(用20%NaOH调至pH8-9) |
||||||||
|
|
固化囊 |
|
||||||||
|
|
↓ |
水洗至无甲醛 |
||||||||
|
|
微囊 |
|
||||||||
|
|
↓ |
|
||||||||
|
|
制剂 |
|
||||||||
*稀释液配法:稀释液即Na 2SO4溶液,其浓度由凝聚囊系统中的Na 2SO4浓度(如为a%)加1.5%[得(a+1.5)%],稀释液体积为凝聚囊系统总体积的3倍.稀释液温度为15℃。所用稀释液浓度过高或过低,可使凝聚囊粘连成团或溶解。
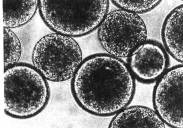
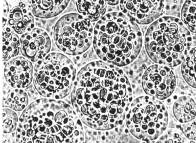
例如复方左炔诺孕酮单凝聚微囊[23],将左炔诺孕酮(LNG)与雌二醇(Ez)混匀,加到明胶溶液中混悬均匀,以硫酸钠溶液为凝聚剂制成微囊,形状见图6-7。粒径在10-40µm的占总重量95%以上,平均体积径为20.7µm。
(3)成囊条件
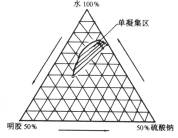
1) 凝聚系统的组成:单凝聚法可以用三元相图来寻找成囊系统产生凝聚的组成范围。如明胶-水-硫酸钠系统的单凝聚三元相图(图6-8)。
|
|
|
|
图6-7 左炔诺孕酮与雌二醇单凝聚囊(×256倍) |
图6-8 明胶水硫酸钠单凝聚三元相图 |
2)明胶溶液的浓度与温度:增加明胶的浓度可加速胶凝,浓度降低到一定程度就不能胶凝,同一浓度时温度愈低愈易胶凝,而高过某温度则不能胶凝,浓度愈高的可胶凝的温度上限愈高。如5%明胶溶液在18℃以下才胶凝,而15%明胶可在23℃以下胶凝。通常明胶应在37℃以上凝聚成凝聚囊,然后在较低温度下粘度增大而胶凝。明胶单凝聚成囊时的温度在40、45、50、55、60℃时其产率、粒径大小和分布均不相同,如50℃时产率为63%.其中65%以上的微囊粒径为5.5µm,而40和45℃时的产率分别为74%和95%,但粒径为5.5µm的分别只有37.4%和33%,而55和60℃时产率分别为72%和58%,且多数微囊的粒径小于2µm。又如CAP单凝聚时,用Na2SO4作凝聚剂,成囊后凝聚相与水相的界面张力较大,囊形不好,需升高温度且加入水以降低界面张力,即可以改善囊形。
3)药物及凝聚相的性质:单凝聚法在水性介质中成囊,因此要求药物难溶于水,但也不能过分疏水,否则仅形成不含药物的空囊。成囊时系统含有互不溶解的药物、凝聚相和水三相。微囊化的难易取决于明胶同药物的亲和力,亲和力强的易被微囊化。可由界面张力加以说明。
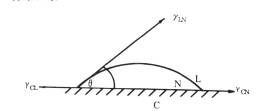
平衡时界面上几种界面张力γ的关系如图6-9,
|
|
|
图6-9 凝聚相界面上的界面张力与接触角 |
其相关式如: γCL=γCN+γCNCOSθ
6-1
式6-1脚标C表示药物,L表示溶液,N表示凝聚相。要凝聚相完全铺展在药物上的条件是:接触角θ=0°,或γCL≥γCN+γLN.实际上,只要凝聚相与药物有相当的亲和力,即使
90°>0>0°,凝聚相也会在药物表面上润湿、铺展。当药物表面粗糙并升高温度时,由于界面能大而凝聚相粘度降低,被凝聚相润湿的药物表面上θ角会进一步降低,可促进凝聚囊的形成。
如果作为囊心物的药物过分亲水则易被水包裹,只存在于水相中而不能混悬于凝聚相中成囊,如淀粉或硅胶作囊心物都因过分亲水而不能成囊。如药物过分疏水,因凝聚相中含大量的水,使药物既不能混悬于水相中,又不能混悬于凝聚相中,也不能成囊,如双炔失碳酯,但加入司盘20可适当增大双炔失碳酯的亲水性,就可以成囊。药物的亲水性适当,如非那西丁可包囊,但加入聚山梨酯80后,使药物亲水性过大,因此不能成囊。
4)凝聚囊的流动性及其与水相间的界面张力:为了得到良好的球形微囊,凝聚后的凝聚囊应有一定的流动性。如用A型明胶制备微囊时,可滴加少许醋酸使溶液的pH值在3.2-3.8之间,能得到比不调pH值更小的球形囊,因为这时明胶分子中有较多的-NH3+离子,可吸附较多的水分子,降低凝聚囊-水间的界面张力.凝聚囊的流动性好,使凝聚囊易于分散呈小球形。若调整溶液的pH值至10-11则不能成囊,因太接近等电点,有大量粘稠块状物析出。而B型明胶则不调pH值也能成囊。
5)固化:欲制得不可逆的微囊,必须加入固化剂固化,同时还要求微囊间的粘连愈少愈好。常使用甲醛作固化剂,通过胺醛缩合反应使明胶分子互相交联而固化。交联的程度受甲醛的浓度、反应时间、介质的pH值等因素的影响,交联的最佳pH值范围是8-9。若交联不足则微囊易粘连,若交联过度,所得明胶微囊脆性太大,其反应式如下;
R-NH2+HCHO+NH2-R’→R-NH-CH2-NH-R’+H2O
若药物不宜在碱性环境,可改用戊二醛代替甲醛,在中性介质使明胶交联固化.戊二醛对明胶的固化作用可采用希夫反应(Schiff reaction)表示:
RNH2+OHC-(CH2)
3-CHO+H2NR’→RN=CH-(CH2)
2-CH=NR’+2H2O
实际上戊二醛在水溶液中常以聚合物的形式存在、如二聚体、多聚体等.多聚体还可以形成环状。
(4)影响成囊的因素
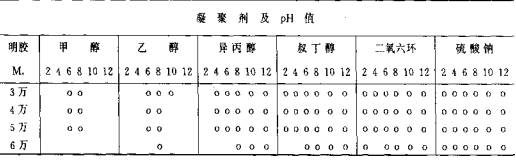
1)凝聚剂的种类和pH值:用电解质作凝聚剂时、阴离子对胶凝起主要作用,强弱次序为枸橼酸>酒石酸>硫酸>醋酸>氯化物>硝酸>溴化物>碘化物,阳离子电荷数愈高的胶凝作用愈强。当用分子量分别为3万、4万、5万及6万的A型明胶(等电点8.5).配成5%溶液,调pH值分别达到2、4、6、8、10及12时,各加入—定量药物,在搅拌下分别加入6种不同的凝聚剂,倒入冰水中胶凝,静置、分离,用冷异丙醇洗后,用10%甲醛的异丙醇溶液固化并脱水,再真空干燥,即得含药的粉末状微囊。结果见表6-4,其中“o”表示能凝聚成囊。如用甲醇作凝聚剂时,仅分子量(Mr)在3万-5万的明胶在pH 6-8能凝聚成囊;而用硫酸钠作凝聚剂时,M r在3万-6万的明胶在pH 2-12均能凝聚成裳;余类推。
表6-4 明胶单凝聚条件
2)药物吸附明胶的量:当用单凝聚法制备活性炭、卡巴醌、SD等几种药物的明胶微囊时,分别用乙醇、硫酸钠等作凝聚剂。药物多带正电荷而具有一定ζ电势,加入明胶后,因吸附带正电的明胶使药物的ζ电势值增大。发现明胶ζ电势的增加值较大者(9-90mV),均能制得明胶微囊;而ζ电势的增加值较小者(0-8mv),往往就无法包裹成囊,只有当药物为活性炭时才能包裹成囊。研究发现,ζ电势的增加值反映了被吸附的明胶量、实际是吸附明胶的量要达到一定程度才能包裹成囊。
3)增塑剂的影响:为了使制得的明胶微囊具有良好的可塑性,不粘连、分散性好,常须加入增塑剂,如山梨醇、聚乙二醇、丙二醇或甘油等。Nikolayey等研究表明,在单凝聚法制备明胶微囊时加入增塑剂,可减少微囊聚集、降低囊壁厚度,且加入增塑剂的量同释药半衰期τ1/2间呈负相关。
2.复凝聚法 复凝聚法(Complex coacervation)系使用两种带相反电荷的高分子材料作为复合囊材,在一定条件下交联且与囊心物凝聚成囊的方法。可作复合材料的有明胶与阿拉伯胶(或CMC或CAP等多糖)、海藻酸盐与聚赖氨酸、海藻酸盐与壳聚糖、海藻酸与白蛋白、白蛋白与阿拉伯胶等。
现以明胶与阿拉伯胶为例,说明复凝聚法的基本原理。将明胶溶液pH值自等电点以上调至等电点以下使之带正电(pH4.0-4.5),而阿拉伯胶仍带负电,由于电荷互相吸引交联形成正、负离子的络合物,溶解度降低而凝聚成囊。复凝聚法是经典的微囊化方法,它操作简便,容易掌握.适合于难溶性药物的微囊化,复凝聚法的工艺流程如下:
|
|
固体或液体药物 |
|
2.5-5%明胶与2.5-5%阿拉伯胶溶液 |
|
|||||||
|
|
↘↙ |
|
|||||||||
|
|
↓ |
|
|||||||||
|
|
混悬液或乳状液 |
|
|||||||||
|
50-55℃ |
↓ |
5%醋酸溶液 |
|||||||||
|
|
凝聚囊 |
|
|||||||||
|
30-40℃的水 |
↓ |
用量为成囊系统的l-3倍 |
|||||||||
|
|
沉降囊 |
|
|||||||||
|
10℃以下 |
↓ |
37%甲醛溶液(用20%NaOH调pH至8-9) |
|||||||||
|
|
固化囊 |
|
|||||||||
|
|
↓ |
水洗至无甲醛 |
|||||||||
|
|
微囊 |
|
|||||||||
|
|
↓ |
|
|||||||||
|
|
制剂 |
|
|||||||||
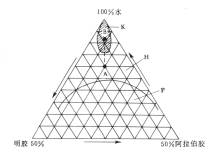
如用明胶及阿拉伯胶为材料.介质水、明胶、阿拉伯胶三者的组成与凝聚现象的关系,可由图6-10三元相图说明。图中K为复凝聚区,即可形成微囊的低浓度明胶和阿拉伯胶混合溶液;P为曲线以下两相分离区,两胶溶液不能混溶亦不能形成微囊;H为曲线以上两胶溶液可混溶形成均相的溶液区。A点代表10%明胶、10%阿拉伯胶和80%水的混合液,必须加水稀释,沿A-B虚线进入凝聚区K才能发生凝聚。
相图说明,明胶同阿拉伯胶发生复凝聚时.除pH值为主要条件外,浓度也是重要条件。
如氯贝丁酯复凝聚微囊,作者将液态氯贝丁酯与明胶、阿拉伯胶制成乳状液,加醋酸溶液使复凝聚成型,加水稀释,用甲醛固化即得,见图6-11。
复凝聚法及单凝聚法对固态或液态的难溶性药物均能得到满意的微囊。但药物表面都必须被囊材凝聚相所润湿,从而使药物混悬或乳化于该凝聚相中,才能随凝聚相分散而成囊。因此可根据药物性质适当加入润湿剂。此外还应使凝聚相保持一定的流动性,如控制温度或加水稀释等,这是保证囊形良好的必要条件。
|
|
|
|
图6-10 明胶、阿拉伯胶在pH4.5用水稀释的复凝聚三元相图 |
图6-11 氯贝丁酯复凝聚囊 (×254倍) |
3.溶剂-非溶剂法
溶剂-非溶剂法 (solvent-nonsolvent)是在囊材溶液中加入一种对囊材不溶的溶剂(非溶剂),引起相分离,而将药物包裹成囊的方法。常用囊材的溶剂和非溶剂的组合见表6-5。药物可以是固态或液态,但必须对溶剂和非溶剂均不溶解。也不起反应。使用疏水囊材,要用有机溶剂溶解,疏水性药物可与囊材混合,亲水性药物不溶于有机溶剂,可混悬或乳化在囊材溶液中。然后加入争夺有机溶剂的非溶剂,使材料降低溶解度而从溶液中分离,滤过,除去有机溶剂即得微囊。
表6-5 常用囊材的溶剂、非溶剂
|
囊材 |
溶剂 |
非溶剂 |
|
乙基纤维素 苄基纤维素 醋酸纤维素丁酯 聚氯乙烯 聚乙烯 聚醋酸乙烯酯 苯乙烯马来酸共聚物 |
四氯化碳(或苯) 三氯乙烯 丁酮 四氢呋喃(或环己烷) 二甲苯 氯仿 乙醇 |
石汕醚 丙醇 异丙醚 水(或乙二醇) 正己烷 乙醇 醋酸乙酯 |
如制备促肝细胞生长素微囊,作者将该药物的浓溶液分散在液状石蜡中,与乳化剂及CAP(丙酮和乙醇溶解)搅拌乳化。加入氯仿(非溶剂)析出后,离心、用乙醚洗涤、干燥,即得类白色粉末状微囊。平均粒径12.7µm,载药量29.7%.药物的包封产率可达95.7%。
4.改变温度法 本法不加凝聚剂,而通过控制温度成囊。EC作囊材时,可先在高温溶解,后降温成囊。使用聚异丁烯(PIB,Mmw=3.8×lO5)作稳定剂可改善微囊间的粘连。用PIB与EC、环己烷组成的三元系统,在80℃溶解成均匀溶液,缓慢冷至45℃,再迅速冷至25℃,EC可凝聚成囊。
以改变温度法用EC将维生素C微囊化时使用了几种分散剂(浓度均为3%),防止粘连的效率是,丁基橡胶>PIB>>聚乙烯>>空白(不加分散剂),而释药速率PIB<聚乙烯<空白<<丁基橡胶。PIB最有效且最能提高囊膜质量的最佳用量.随其Mmw不同而稍有不同、当Mmw=3.6×105或6×105 时.最佳用量范围分别有人报道为4.7%-7%或3%,当Mmw=(2-4)×l05时,用3%改善囊膜,且可缓释。EC在环已烷中的溶解度随FIB的加入而降低.而凝聚相的体积则随PIB的Mmw增大而增大。低Mmw的PIB仅在75℃才能形成球形的EC微囊.55℃至65℃则转变成不规则形.故易粘连。当用高Mmw的PIB时,形成的微囊粒径很小。呈分离的球状实体。有人用类似方法在环己烷中制得维生素C的EC微囊,有一定的缓释性并防止氧化,其体外释药符合一级动力学方程.且释药速率随囊膜厚度增大而递减。也有人用蜂蜡作囊材,将维生素C晶体在热丙酮中成囊,冷却固化得微囊。
5.液中干燥法 从乳状液中除去分散相挥发件溶剂以制备微囊的方法称为液中干燥法(in-liquid drying),亦有人称为溶剂挥发法。
液中干燥法的干燥工艺包括两个基本过程:溶剂萃取过程(两液相之间)和溶剂蒸发过程(液相和气相之间)。按操作可分为连续干燥法、间歇干燥法和复乳法,前二者应用O/W型、W/O型及O/O型(如乙腈/液状石蜡、丙酮/液状石蜡等)乳状液,复乳法应用W/O/W型或O/W/O型复乳。它们都要先制备囊材的溶液,乳化后囊材溶液处于乳状液中的分散相,与连续相不易混溶,但囊材溶剂对连续相应有一定的溶解度,否则,萃取过程无法实现。连续干燥法及间歇干燥法中,如所用的囊材溶剂亦能溶解药物,则制得的是微球,否则得到的是微囊.复乳法制得的是微囊。
连续干燥法制备微囊的基本工艺流程如下:
|
在易挥发溶剂中将囊材溶解并将药物分散 |
|
||||||
|
|
↓ |
加连续相及乳化剂 |
|||||
|
|
乳浊液 |
|
|||||
|
|
↓ |
连续蒸发除去囊材的溶剂 |
|||||
|
|
微囊 |
|
|||||
如囊材的溶剂与水不易混溶,多用水作连续相,加入亲水性乳化剂(如极性的多元醇),制成O/W型乳状液;亦可用高沸点的非极性液体如液状石蜡作连续相,制成O/O型乳状液。如囊材的溶剂能与水混溶,则连续相可用液状石蜡,加入油溶性乳化剂(如司盘80或85),制成W/O型乳状液。根据以上连续相的不同,又可分别称为水中干燥法及油中干燥法。
如布洛芬既可采用水中干燥法,亦可采用油中干燥法制备微囊。水中干燥法微囊化的操作;将EC溶于CH2Cl2中、加入过100目筛的布洛芬粉末,在30℃水浴中250RPM搅拌20分钟,继续搅拌,加入含0.5%表面活性剂的100m1蒸馏水中,水温由30℃逐步升高到40℃,330RPM搅拌3小时,滤过,用50m1蒸馏水洗涤3次,室温干燥24小时,即得粉末状微囊。油中干燥法微囊化的操作:将Eugragit RS溶于丙酮中,加入过100目筛的布洛芬粉末,在10℃水浴中250RPM搅拌20分钟,继续搅拌,加到在190RPM搅拌下的同一水浴中的液状石蜡200m1中,水浴温度由10℃逐步升高到35℃,在190RPM下搅拌4小时,滤过.用正己烷洗涤3次,减压干燥即得粉末状微囊。
用O/W型乳浊液的连续干燥法,所得微囊表面常含药物的微晶体。但如果控制干燥速率,使初步干燥的微囊换纯水迅速萃取形成硬膜再继续干燥,即可得满意的微囊,称间歇干燥法。
连续干燥法或间歇干燥法如用水作连续相,不宜制作水溶性药物的微囊,因其中的药物易进入水相而降低包封产率和载药量,可不用水而改用O/O型乳浊液。
用O/O型乳浊液药物仍可能在微粒表面形成微晶体,或有药物进入连续相微囊不是流动性好的粉末。
复乳法可克服以上缺点。常用W/O/W型复乳法的工艺流程如下:
|
囊材的有机溶剂溶液(含亲油性乳化剂) |
|
药物水溶液(含增稠剂) |
|
|||||
|
|
↘↙ |
|
||||||
|
|
↓ |
|
||||||
|
|
W/O型乳浊液 |
|
||||||
|
冷却(15℃)以增大水相粘度 |
↓ |
加含亲水性乳化剂的水作连续相 |
||||||
|
|
W/O/W型复乳 |
|
||||||
|
|
↓ |
蒸发除去材料的溶剂、分离、干燥 |
||||||
|
|
微囊 |
|
||||||
以阿拉伯胶和EC为囊材,以复乳法制备微囊时,可将阿拉伯胶水溶液分散在含EC的乙酸乙酯有机相中形成W/O型乳浊液,阿拉伯胶与EC在分散相和连续相的界面分别形成两层吸附膜,见示意图6-12(a),乳浊液进一步与阿拉伯胶溶液乳化,形成W/O/W型复乳,出现新的水/油界面,阿拉伯胶与EC再一次形成两层吸附膜,如图6-12 (b)。透析除去内、外EC膜之间的乙酸乙酯有机溶剂,滤过,得内外层都是阿拉伯胶膜、中间是EC膜的三层膜的微囊,其粒径在50µm以下,如图6-12(C)。
|
|
|
图6-12 W/O/W型微囊示意图 |
(二)物理机械法
本法是将固态或液态药物在气相中进行微囊化,需要一定设备条件。
1.喷雾干燥法 喷雾干燥法(spray drying)又称液滴喷雾干燥法。喷雾干燥法可用于固态或液态药物的微囊化,粒径范围为5-600µm。工艺是先将囊心物分散在囊材的溶液中,再用喷雾法将此混合物喷入惰性热气流使液滴收缩成球形,进而干燥固化。如囊心物不溶于囊材溶液,可得到微囊,如作者制得降肺动脉高压的汉防己甲素微囊,见图6-13;
|
|
|
图6-13 汉防已甲素喷雾干燥白蛋白微囊 (×15000倍) |
如能溶解,可得微球。溶解囊材的溶剂可以是水,也可以是有机溶剂,目前主要以水作溶剂。喷雾干燥设备参见第七章“喷雾造粒装置”。
喷雾干操法的工艺影响因素包括混合液的粘度、均匀性、药物及囊材的浓度、喷雾的速率、喷雾方法及干燥速率等。干燥速率由混合液浓度与进出口的温度决定。由于囊心物比例不能太大才能被囊膜包裹.通常囊膜多孔,故所得微囊产品堆密度较小.如囊心物为液态,通常其在微囊中含量不超过30%.
微囊带电易引起粘连,在最后干燥阶段更是如此.如囊材中含有聚乙二醇作搞粘剂时,可降低微囊带电而而减少粘连;处方中使用水或水溶液.或在工艺中采用连续喷雾而无间歇时,均可减少微囊带电而避免粘连.粒径小的囊心物包囊时,囊材溶液中加入抗粘剂制成混悬液,可减少微囊粘连,常用的抗粘剂见表6-6,二氧化硅,滑石及硬脂酸镁等亦可以粉状加在筒成品中,以减少贮存时的粘连,或在压片或装空心胶囊时改善微囊的流动性。
表6-6 包裹时使用的抗粘剂常用量
|
抗粘剂 |
用于囊材溶液中 (g/100g囊材) |
用于微囊成品中 (g/100g) |
|
滑石 |
20-100 |
1-3 |
|
硅胶 |
3-20 |
1-3 |
|
硬脂酸镁 |
10-50 |
0.5-3 |
|
单硬脂酸甘油酯 |
1-3 |
- |
制备磁共振成像造影剂钆喷葡胺(gadopentetate dimeglumine)的EC微囊时,采用多层(5层)喷雾包衣法,产品粒径126µm[24]。
2. 喷雾凝结法 将囊心物分散于熔融的囊材中,再再喷于冷气流中凝聚而成囊的方法,称为喷雾凝结法(spray
congealing),常用字的囊材有蜡类、脂肪酸和脂肪醇等,它们在室温均为固体,而在较高温度能熔融,如盐酸美西律(mexiletine hydrochloride)为囊心物,用硬脂酸和EC为复合囊材,以34.31-68.62kPa的压缩空气通过喷雾凝结法成囊,粒径8-100µm。
3. 空气悬浮法 空气悬浮法(air suspension)亦称流化床包衣法(fluidized bed coating),系利用强气流使囊心物悬浮在包衣
室中,囊材溶液通过喷嘴喷射于囊心物表面,使囊心物悬浮的热气流将溶液挥干,囊心物表面便形成囊材薄膜得微囊.设备装置基本上与片剂悬浮包衣装置相同.本法所得的微囊粒径一般在35-5000µm范围.囊材可以是多聚糖、明胶、树脂、蜡、纤维素衍生物及合成聚合物.在悬浮成囊的过程中,药物虽已微粉化,但在流化床包衣过程中可能会粘结,因此可加入第三种成分如滑石粉或硬脂酸镁,先与微粉化药物粘结成一个单位,然后再通过流化床包衣,可克服微粉化药物的粘结。
近年来,快速崩解膜、肠溶衣、缓释膜等几乎所有能控制释放的膜,都可由水溶液处方用流化床包衣法制备。
4.多孔离心法 利用离心力使囊心物高速穿过囊材的液态膜,再进入固化浴固化制备微囊的方法称为多孔离心法(multiorifice centrifugal process)。它利用圆筒的高速旋转产生离心力,利用导流坝不断溢出囊材浴液形成液态膜。囊心物(液态或固态)高速穿过液态膜形成微囊,再经过不同方法加以固化(用非溶剂、凝结或挥去溶剂等),即得微囊。
5.锅包衣法 锅包衣法(pan coating)系利用包衣锅将囊材溶液喷在固态囊心物上挥干溶剂形成微囊,导入包衣锅的热气流可加速溶剂挥发。
上述几种物理机械法均可用于水溶性和脂溶性的、固态或液态药物的微囊化,其中以喷雾干燥法最常用。通常、采用物理机械法时囊心物有一定损失且微囊有粘连,但囊心物损失在5%左右、粘连在10%左右、生产中都认为是合理的。
(三)化学法
利用在溶液中单体或高分子通过聚合反应或缩合反应,产生囊膜制成微囊,这种微囊化的方法称为化学法。本法的特点是不加凝聚剂.常先制成W/O型乳浊液,再利用化学反应交联固化。
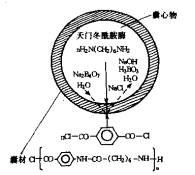
1.界面缩聚法 界面缩聚法(Interface po1ycondensation)亦称界面聚合法,是在分散相(水相)与连续相(有机相)的界面上发生单体的缩聚反应。例如,水相中含有1,6-已二胺和碱,有机相为含对苯二甲酰氯的环已烷、氯仿溶液,将上述两相混合搅拌,在水滴界面上发生缩聚反应.生成聚酰胺,反应式如下:
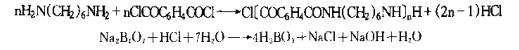
由于缩聚反应的速率超过l,6-己二胺向有机相扩散的速率,故反应生成的聚酰胺几乎完全沉积于界面成为囊材。如L-门冬酰胺酶微囊:取L-门冬酰胺酶10mg及门冬酸50mg溶于1m1人体O型血红蛋白液和1.5m1、pH8.4硼酸缓冲溶液中,加1ml 1,6-己二胺的碱性硼酸钠溶液.置于反应瓶中,再加20m1混合试剂(由环己烷150m1、氯仿30m1、司盘85 0.9ml混匀组成)、置4℃冰浴中3000RPM搅拌1分钟,加对苯二甲酰氯15mL,继续搅拌5分钟,最后加30m1混合溶剂,继续搅拌0.5分钟,显微镜下观察已形成微囊。此囊立即转入离心管中,1000RPM离心1分钟,去上清液,加25m1分散液(12.5m1吐温20加12.5m1蒸馏水),搅拌3分钟,加50m1蒸馏水,继续搅拌1分钟,再倾去上清液,微囊混悬于生理盐水中,4℃保存。微囊平均粒径20µm,其示意图如图6-14。
|
|
|
图6-14 门冬酰胺酶以界面缩聚法包囊示意图 |
2.辐射交联法 该法系将明胶在乳化状态下,经γ射线照射发生交联,再处理制得粉末状微囊。该工艺的特点是工艺简单,不在明胶中引入其它成分。现以门冬酰胺酶明胶为例,介绍其工艺流程如下:
|
50g/L明胶水溶液 |
|
液状石蜡(含乳化剂硬脂酸钙) |
||||||||||||||
|
|
↘↙ |
|
||||||||||||||
|
|
↓ |
搅拌30分钟 |
||||||||||||||
|
|
稳定乳浊液(W/O型) |
|
||||||||||||||
|
|
↓ |
通氮气 |
||||||||||||||
|
|
无氧乳浊液 |
|
||||||||||||||
|
|
↓ |
60Co放射源照射(放射率为25. 8C/(kg·h),总照射量774-1290C/kg) |
||||||||||||||
|
|
乳浊液 |
|
||||||||||||||
|
|
↓ |
速离心破乳,倾去液状石蜡 |
||||||||||||||
|
|
明胶微囊 |
|
||||||||||||||
|
|
↓ |
用乙醚洗、乙醇洗、真空干燥 |
||||||||||||||
|
|
粉末状明胶微囊 |
|
||||||||||||||
|
|
↓ |
浸吸门冬酰胺酶水溶液,保干器除水 |
||||||||||||||
|
|
粉末状门冬酰胺酶明胶微囊 |
|
||||||||||||||
所制得的明胶微囊粒径可达30µm以下,其在0.25、1.0、10.5、47、72小时的体外释药量(活力单位)分别为202、566、739、769、789,其释药规律符合方程3/2[1-(1-Q)2/3]-Q=f(t)。
l-门冬酰胺是人体细胞的必需品.正常细胞能自身合成.而癌细胞则须靠宿主提供。用门冬酰胺酶将1-门冬酰胺水解,则癌细胞失去赖以生长的l-门冬酰胺而死亡。门冬酰胺酶常用于治疗急性淋巴细胞白血病,但酶类属于异性蛋白,可引起过敏反应,长期注射可产生抗体而失活。将其制备成微囊可以避免过敏反应和失活。有人将门冬酰胺酶微囊对小白鼠腹腔注射,发现第一周分布在整个腹腔内,第二周腹腔上部仍有微囊浓集。一次注射70万单位,在腹腔的有效期至少保持4周。一般门冬酰胺酶水溶液注射后.作为异性蛋白而被迅速排泄。微囊内的门冬酰胺酶可滞留在腹腔内,继续释放药物而抑制肿瘤的生长。
三、微囊的性质
(一)微囊的形态、结构与粒径
1.微囊的形态与结构 理想的微囊应为大小均匀的球形,囊与囊之间不粘连,分散性好,便于制成制剂。微囊的结构随着工艺条件的不同而有差异。通常单、复凝聚法与辐射交联法所得的微囊是球形镶嵌型,且是多个囊心物微粒分散镶嵌于球形体内。物理机械法、界面缩聚法、溶剂-非溶剂法以及复乳包囊法所得的微囊是球形膜壳型,其中物理机械法制得的微囊可以含多囊心物或单囊心物,但界面缩聚法只能制得单囊心物微囊。
微囊本身应具有一定的可塑性和弹性。若用明胶为囊材,加入l0%-20%甘油或丙二醇即可改善明胶囊材的弹性;若加入低粘度乙基纤维素可减少膜壁的细孔,亦可加入70%糖浆使多孔性的缺点得到改善,若用乙基纤维亲为囊材,应加入增塑剂改善其可塑性.
2.微囊的粒径 口服粒径小于200µm的微囊(与粘性的液体或食物共服)时,在口腔内即无异物感。故常要求制备小粒径的口服微囊。但粒径太小则操作时粘连严重。微囊的粒径还直接影响药物的释放、生物利用度、载药量、有机溶剂残留量以及体内分布的靶向性等。
如25%炔诺酮以丙交酯乙交酯(85:15)共聚物为囊材的微囊在37℃、275g/L乙醇液中一定时间内的体外释放量,是随着微囊的粒径增大而降低。如采用溶剂-非溶剂法制得顺铂微囊,在测定其有机溶剂二氯甲烷的残留量时,发现粒径20-50µm的残留量为0.028%,100-300µm的为0.191%,200-300µm的为0.760%,300-400Pm的为1.830%,说明粒径愈大,有机溶剂残留量愈多。
12-19µm的丝裂酶素C微囊静注后.大鼠体内集中分布于肺,高峰时为95.4%,2小时为88.4%,24小时为59.9%,而在肝中只有3.6%。又如142Ce聚苯乙烯二乙烯基醚微囊,经Beag1e犬静注后,7-12µm的微囊在体内24小时集中于肺内达42.8%-58.8%.而在肝中只有6.5%-0%,若3-5µm的微囊集中于肺的只有1.2%-12.4%,而在肝中有62.5%-50.9%。
(二)影响微囊粒径的因素
1. 囊心物的大小 150-250µm的维生素C粉末用相分
离法制成微囊,其平均粒径为512µm,且粒径范围分布较窄;小于120µm的维生素C制得的微囊也小,但其粒径范围分布较广,为250-500µm.由更粗的维生素C所制成的微囊较大,分布范围也广。通常如要求微囊的粒径约为10µm时.囊心物粒径应达到l-2µm;要求微囊的粒径约为50µm时,囊心物粒径应在6µm以下。对不溶子水的液态药物,用相分离法制备微囊时.如先乳化再微囊化,可得小而均匀的微囊。
2. 囊材的的用量 一般药物粒子愈小其表面积愈大,要制成囊壁厚度相同的微囊,所需囊材愈多.
3. 制备方法 制备方法影响微囊的粒径,见表6-7.
4. 制备温度 以乙基纤维素为囊材的茶碱微囊,囊心物与囊材的重量比为1︰1,甲苯-石油醚为l︰4,采用溶剂-非溶剂法搅拌速率380RPM成囊温度分别用0、20、40℃,微囊粒径见表6-8.
表6-7 微囊化方法及其适用性和粒径范围
|
微囊化方法 |
适用的囊心物 |
粒径范围(µm) |
|
空气悬浮 |
固态药物 |
35-5000* |
|
相分离 |
固态和液态药物 |
2-5000* |
|
多孔离心 |
固态和液态药物 |
1-5000* |
|
锅包衣 |
固态药物 |
5-5000* |
|
喷雾干燥和凝结 |
固态和液态药物 |
5-600 |
*最大的粒径可超过5000µm.
表6-8 温度对茶碱微囊粒径的影响
|
微囊粒径(µm) |
<90 |
<150 |
<180 |
<250 |
<350 |
<425 |
<710 |
<1000 |
|
|
不同温度 下的微囊 总重(%) |
0℃ |
12.0 |
49.8 |
95.8 |
97.8 |
98.3 |
99.1 |
99.9 |
- |
|
20℃ |
2.2 |
15.7 |
42.1 |
84.7 |
73.1 |
77.9 |
91.4 |
94.8 |
|
|
40℃ |
0.5 |
3.9 |
10.3 |
62.0 |
76.3 |
89.2 |
93.9 |
98.4 |
|
5.制备时的搅拌速率 在一定温度下高速搅拌,微囊粒径小,低速搅拌粒径大。血红蛋白微囊在800RPM时得微囊平均粒径为19.2µm。而用乳匀机,由于转速高,得平均粒径为4.9µm的微囊。
但无限制地提高搅拌速度,微囊可能因碰撞合并而粒径变大。此外.搅拌速率又取决于工艺的需要。如明胶为囊材时,以相分离法制备微囊的搅拌速率不宜太高,所得微囊粒径约为50-80µm;因高速搅拌产生大量气泡会降低微囊的产量和质量。
6.附加剂的浓度 例如采用界面缩聚法且搅拌速率一致,但分别加入浓度为0.5%与5%的司盘85,前者可得小于100µm的微囊,而后者则得小于20µm的微囊。又如用丙交酯乙交酯(重量比78:22)共聚物为囊材,制备醋炔诺酮肟微囊时,加入乳化剂明胶的浓度不同则平均粒径不同:1%明胶得70.98µm,2%明胶得79.8lµm,3%明胶得59.36µm,4%明胶得46.77µm。
(三)微囊中药物的释放
药物微囊化后,一般要求药物能定时定量地从微囊中释放出来,达到临床预定的要求。
1.微囊中药物释放的速率与机制 Luu Si-Nang等对微囊中难溶性药物的释放速率作了理论处理,求得总释放速率为;
(dc/dt)总=(3Dm/Vrd)(Nh/a+ε/h)(C1-C) 6-2
式中D是药物分子的扩散系数,m是微囊的总质量,V是介质的容积,r是微囊的平均半径,d是微囊的密度,N是搅拌速率,a、b是常数, ε是与囊壁的多孔性有关的特性常数,h是囊壁的厚度(用显微镜切片直接测得或根据囊心物与囊材的重量比与微囊直径进行估算),C1是药物的溶解度,C是药物在介质中的浓度。从式6-2可知,对一定的药物和囊材来说.微囊中药物释放的总速率与ε、h、r等有关。将该式积分,当C1>>C时得:
C=C1(3Dm/Vrd)(Nh/a+ε/h)t 6-3
上式反映的规律属零级释放,即在有关条件不变时介质中浓度与时间成正比;亦即释放速率为常数,不随时间改变。研究表明,水杨酰胺微囊、苄基氰甲基头抱菌素微囊、丙脒腙微囊等确是如此。但以明胶为囊材的氯贝丁酯微囊在囊壁较薄时,并不遵守零级释放规律;而当囊壁增加到10.4µm以上时,C与t之间才出现正比关系。
微囊中药物的释放也有符合其他释放规律的。例如吲哚美辛明胶—CAP微囊和雌二醇明胶微囊,体外释放符合Higuchi方程;茶碱微囊却符合一级释放规律。
要深入了解微囊释药速率规律.应考虑释药机制,通常有以下三种:
(1)扩散:药物透过囊壁扩散,即微囊进入体内后,体液向微囊中渗透而逐渐使微囊中药物溶解扩散出囊壁,这是物理过程,囊壁不溶解。也有人提出药物释放首先是己溶解或粘附在囊壁中的少量药物发生短暂的快速释放,称为突破效应(burst effect),然后才是囊心物溶解成饱和溶液而扩散出微囊。例如氯贝丁酯微囊当囊壁较厚时.药物的释放可分为4个阶段:①初期的迅速释放,来自溶解在囊壁中的药物;②慢速释放、来自囊心药物的溶解并扩散透过囊壁;③较快速的稳态释放,来自囊心药物的饱和溶液,维持时间也最长;④最后较缓慢的释放,来自药物的残留部分。这时已不足以维持所需的浓度梯度。
(2)囊壁的溶解:囊壁溶解的速率主要取决于囊材的性质、体液的体积、组成、pH值以及温度等,但不包括酶的作用。属于物理化学过程。
(3)囊壁的消化与降解:这是在酶作用下的生化过程。当微囊进入体内后,囊壁可受胃蛋白酶或其它酶的消化与降解成为体内的代谢产物,而使药物释放出来。但是用合成的生物降解的聚合物作囊材,在降解之前,药物早已开始释放。例如丙交酯乙交酯[50︰50]共聚物为囊材的纳福肽醋酸盐(naferelin acetate)微囊在体内释放情况。其释放机制分3个阶段,第一阶段为最初的快速释放阶段,药物从微囊壁中扩散释出;第二阶段是聚合物水解并同时分子量减小,但仍保持其不溶性,药物扩散释出;第三阶段是低分子碎片的溶解和聚合物主体的融蚀使药物释放。后两个阶段虽表现为囊壁的降解、消化与溶解.但药物仍须经过溶解与扩散而表现不同的释放速率。因此不能将其全过程用—根直线表示为零级释放。
2.影响微囊药物释放速率的因素
(1)微囊的粒径:在囊壁的材料和厚度相同的条件下,微经粒径愈小表面积愈大,释药速率也应愈大。例如磺胺嘧啶微囊.其累积释放速率随粒径减小而增高。
(2)囊壁的厚度:囊壁材料相同时,囊壁愈厚释药愈慢;也可以说,囊心物与囊壁的重量比愈小,释药愈慢。例如磺胺噻唑微囊,乙基纤维素为囊材、微囊的囊壁厚度分别为5.04、13.07、20.12µm,在人工胃液中作体外溶出速率测定.结果以t1/2表示,分别为11、16及30分钟,并求得直线方程t1/2=1.17h+4.32,说明微囊的囊壁(h)愈厚,释放速率愈低。
(3)囊壁的物理化学性质:不同的囊材形成的囊壁具有不同的物理化学性质。如明胶所形成的囊壁具有网状结构,药物嵌入网状孔隙中,孔隙很大,即式6-2中的常数ε大,因此药物能较快速释放。若是囊壁由聚酰胺形成,其孔隙半径小(约1.6nm),药物释放比明胶微囊慢得多。孔隙率较小即特性常数ε较小的囊材,形成的微囊释药较慢。常用的几种囊材形成的囊壁释药速率的次序如下:
明胶>乙基纤维素>苯乙烯-马来酐共聚物>聚酰胺
若用界面缩聚法包囊,在水相内加入二乙撑三胺(或三乙撑四胺)作交联剂,所形成聚酰胺囊壁孔隙度增大,可使释药加快。用明胶-阿拉伯胶复凝聚法成囊,若欲延缓释放,可加入适量低粘度(0.4cPa·s)的乙基纤维素,使其沉积在囊壁孔隙内堵塞部分孔隙而降低释药速率。
复合囊材亦有不同的释药速率。如磺胺噻唑微囊化时,以明胶-果胶形成的囊壁释药最慢,明胶-海藻酸钠的囊壁释药最快。又如甲硝唑微囊.其囊壁全由乙基纤维素组成,30分钟释药量不足70%,当微囊壁中合10%-30%的聚乙二醇时,30分钟可释放90%以上的药物。但微囊压片时,含聚乙二醇的微囊因压缩产生的热使聚乙二醇熔融,随后固化而使片剂崩解缓慢.释药速率也随之降低。
(4)药物的性质:药物的溶解度与药物释放速率有密切关系,在囊材等条件相同时,溶解度大的药物释放较快。例如用乙基纤维素为囊材,分别制成巴比妥钠、苯甲酸及水杨酸微囊。这三种药物在37℃水中溶解度分别为255、9、0.63g/L,以巴比妥钠的溶解度最大,而药物的释放速率也正是巴比妥纳最大。药物在囊壁与水之间分配系数的大小也反映了水中的溶解度大小,故亦影响释放速率。如囊材为乙基纤维素的巴比妥钠、苯甲酸及水杨酸微囊,其乙基纤维素/水的分配系数分别为0.67、58、151,结果释药t1/2分别为22、70、80分钟,亦是以巴比妥钠释放最快。
因此使药物缓释的方法之一,是将药物先制成溶解度较小的衍生物,或缓释固体分散体,然后再进行微囊化。
(5)附加剂的影响:为了使药物延缓释放,可加入疏水性物质如硬脂酸、蜂蜡、十六醇以及巴西棕榈蜡等。例如地西泮与一定重量的熔融蜂蜡制得的微囊,口服后8-10小时内能均匀释放地西泮.其阻止戊二烯四唑(metrazol)对大鼠诱发惊厥可达10小时之久。又如磺胺嘧啶乙基纤维素微囊采用不同量的硬脂酸为阻滞剂,随着阻滞剂含量增加,药物体外释放速率降低。因硬脂酸溶于有机溶剂中,成囊后充填在乙基纤维素囊壁内起增塑作用.阻塞膜孔使膜致密之故。
(6)工艺条件与剂型:成囊时虽采用其它工艺相同.仅干燥条件不同。则释药速率也不相同,例如冰冻干燥或喷雾干燥的微囊.其释药速率比烘箱干燥的微囊要大些.大概是由于后者每个干燥颗粒中所含的微囊数平均比前二者多得多.表面积大大减小,因而释药变慢。又如将对乙酰氨基酚以醋酸纤维素丁酸酯为囊材,采用不同的乳化工艺,所得的微囊在8小时内释药量结果见表6-9。
表6-9 微囊化的乳化条件不同对释放药物的影响
|
条件* |
微囊粒径(µm) |
8小时内释药量(%) |
微囊中药物含量(%) |
|
a |
769 |
33±5.6 |
77±1.3 |
|
b |
659 |
40±1.9 |
83±1.8 |
|
c |
783 |
51±4.1 |
36±2.9 |
*a.乳化-溶剂蒸发; b.改良乳化-溶剂;c.乳化后加入非溶剂
说明三种微囊虽大小差不多,但用乳化-溶剂蒸发制成的微囊,其8小时内释放的药物显著低于另外二种乳化条件的微囊。
通常微囊有一定的缓释作用.如硝硫氰胺胶囊与微囊片在体外的溶出速率以t1/2表示,前者为8分钟,后者为37分钟。但是微囊与微囊片剂相比,后者的释药可能较快.因经过压片的囊壁可能变薄或破裂。如以乙基纤维素为囊材的苯巴比妥微囊与微囊片剂相比,后者释药较快。新鲜微囊和放置干燥的微囊释药速率也可能不同,如均在pH l.4的盐酸溶液中释药,新鲜的比干燥的尼莫地平微囊释药速率大约快1倍,因为干燥的微囊要先经过吸水溶胀才能有效地释药。
(7)pH值的影响:在不同pH值条件下微囊的释药速率也可能不同。如以壳聚糖-海藻酸盐为囊材的尼莫地平微囊,分别在pH l.4和pH 7.2的缓冲盐溶液中测定其释药速率。在pH 7.2时的释药明显快于pH l.4时,这是由于囊材中的海藻酸盐在pH较高时可缓慢溶解以致微囊破裂。又如氯唑嗪微囊以明胶-阿拉伯胶为囊材,体外试验表明,当pH2时。不到40分钟释放氯噻嗪达100%,但pH9时,120分钟释药还不到80%。
(8)溶出介质离子强度的影响:如将荧光素尼龙微囊50mg混悬在4L pH 7.4的离子强度为0.8、1.0、1.2的磷酸盐缓冲溶液中,其1小时体外释药结果分别为38.78%、64.35%、71.99%。说明不同离子强度的相同介质,微囊释放荧光素的速率也不同。
四、微囊质量的评价
微囊的质量评价是保证微囊中药物发挥应有作用的重要一环。目前虽有商品微囊制剂,但如何圆满地评价微囊的质量也还需要进行深入的研究。
目前微囊的质量评价,除制成制剂应符合药典有关制剂的规定外、大致还包括下述内容.
(一)微囊的囊形与粒径
微囊可采用光学显微镜、扫描或电子显微镜观察形态并提供照片。微囊形态应为圆整球形或椭圆形的封闭囊状物。
不同微囊制剂对微囊粒径有不同的要求。注射剂的微囊粒径应符合药典中混悬注射剂的规定;用于静脉注射起靶向作用时,应符合静脉注射的规定。应提供粒径平均值及其分布数据或图形(如直方图或分布曲线图)。
微囊粒径的测定有多种方法,常用校正过的带目镜测微仪的光学显微镜测定。取试祥置载玻片上,必要时用甘油或液状石蜡稀释(1-2).直接观测至少500个微褒,并将微囊粒径范围划分为若干单元(如5-10、10-15、15-20µm等)。可由式6-4求算术平均径DRV,由式6-5算出每个粒径单元的微囊所占的重量百分率:
![]()
式中n1、n2、……nn为具有粒径d1、d2……dn的粒子数;g为某枚径范围微囊所占重量百分率,N为所数的在某个粒径范围的微囊数,d为某粒径范围内的微囊平均粒径。
将所测得的以上数据,以粒径为横坐标,以频率为纵坐标.可绘制直方图。频率可以用微囊百分率表示(每一单元粒径的微囊个数除以微囊总数),也可以用各单元微囊重量百分率表示,即式6-5。
粒径分布亦可用跨距(span)表不,跨距愈小分布愈窄,即微囊愈均匀;
跨距=(D90一D10)/D50 6-6
式中D10、D50、D90分别表示有10%、50%、90%微囊的粒径均小于该值的粒径。
亦可用电感应法(如Coulter计数器)或光感应法(如粒度分布光度测定仪)测定微囊的粒径及其分布。
(二)微囊中药物含量的测定
微囊中药物含量的测定一般采用溶剂提取法。溶剂的选择原则,主要应应药物最大限度溶出而最少溶解囊材,溶剂本身也不应干扰测定。
(三)微囊中药物的裁药量与包封率
对于粉末状微囊,可以仅测定载药量(drug-loading rate);对处于液态介质中的微囊,可分离微囊后进行测定,再计算载药量和包封率(entrapment rate)。
测定一定重量粉末状微囊内的药量。载药量可由下式求得;
微囊的载药量=(微囊内的药量/微囊的总重量)×100% 6-7
液态介质中的微囊,可用离心或滤过等方法分离微囊后,称取一定重量的微囊,分别测定介质中与微囊内的药量。载药量可由式6-7求得,包封率可由下式计算;
包封率=[微囊内的药量/(微囊内药量+介质中的药量)]×100% 6-8
微囊内的药量占投药量的百分率称为药物的包封产率,对评价微囊的质量意义不大,可用于评价工艺。
微囊的包封产率和载药量高低取决于采用的工艺。喷雾干燥法和空气悬浮法可制得包封产率95%以上的微囊,但是用相分离法制得的微囊,其包封产率常为20%-80%。
(四)微量中药物释放速率
为了掌握微囊中药物的释放规律、释放时间及奏效部位,必须对微囊进行释放速率的测定。根据微囊的特点、可采用《中国药典>1 995年版二部附录镕出度测定法中第二法(浆法)进行测定,亦可将试样置薄膜透析管内按第一法(转篮法)进行测定。如果条件允许,可采用流池法测定。
参考文献
[1]出候曙光 王培玉.盐酸雷尼替丁-β-环糊精包合物的研制 中国药学杂志.1996.31(8);479
[2] 陆彬等, 陈皮挥发油β-环糊精包含物的研究.华西药学杂志、1991.8(1);10
[3] 吴琼珠等,诺氟沙星β-环糊精包含物的研究.中国医药工业杂志.1994,25(10);445
[4] 李国锋等,维A酸环糊精包合物的制备.中国药学杂志,1995,30(8):472
[5] Jimenez MC,et al.,Photodecarboxylation of 2-henylpropionic acid in so1ution and included within β-cyclodextrin.Tetraheron, 1995, 51(10):2953
[6] 何进 华殿洲等,大蒜油-β-环糊精包合物稳定性考察,中国药学杂念,1997.32(4):216
[7] 孙伟张等,盐酸异丙嗪-β-环糊精包合物的制备及其稳定性的初步研究.中国医药工业杂志,1996, 27(11);500
[8] Erden N,Celebi N, A Study of the inclusion complex of naproxen with β-cyclodextrin.Int J Pharm, l 988,18;83
[9] 刘西英 刘云清, 磷酸苯丙哌林-β-环糊精包合物的性质与制剂开发,中国药学杂志,1997,32(4); 218
[10] 星野辉彦ら, β-及ぴジメチルβ-シクロデキストリン包接によゐクロミプラミンの光化学反应性变化, 药学杂志(日)l989,109(2);107
[11] Amididouche D.et al.,lnclusion of retinoic acid in β-cyclodextrin. Int J Pharm 1989,54(2);175
[12] 赵风英 陆彬,双炔尖碳酯-PVP共沉淀物的研究,药学学报,1989,24(3),219
[13] 陆彬 卢丹,吲哚美辛-PEG 6000滴丸的研究.药学学报,1992,27(3);227
[14] 高桥保志, Preparation of solid dispersions of disopyramide with several coating agents and its evaluation.药剂学(日)1992,52(1);32
[15] Murthy KS. et al.,Current perspective on the dissolution stability of solid oral dosage froms.J Pharm Sci.1993,82(2);113
[16] 陆锦芳等,尼莫地平聚乙二醇类固体分散物的制备及其体外溶出度的研究,中国药学杂志,1995,30(1);23
[17]陆彬等, 双炔快失碳酯滴丸的初步研制.中国医药工业杂志,1990,21(9);396
[18]孙桂明 裴元英等,乙基纤维素作为硫酸奎尼丁缓释型固体分散体载体的研究, 上海医科大学学报,1995,22(6),459
[19]赵红 郑俊民等,环孢素A固体分散物一些物性研究.药学学报,l 997,32(10);777
[20] Dzeki T. et a1.,Application of the solid dispersion method to the Controlled release of medicine V. Chem Pharm Bull,1994,42(2);337
[21] Oth MP.Et al.,Sustained release solid dispersions of indomethacin with eudragit RS and RL.Int J Pharm 1989,55;157
[22] Donbrow M,Microcapsules and nanoparticles in medicine and pharmacy, Ed.By Donbrow M.CRC Press Inc.U SA,1992.
[23] LuBin,et al.,Microncapsulation of Drugs.Ed.by whiteley TL.Harwood Academic Publishers.U.K.1992;103
[24] Fukumori Y.et a1.,Design and preparation of ethyl cellulose microcapsules of gadopentetatc dimeg1umine for neutron-capture the rapy using the wurster process, Chem Pharm Bull,1993;41(6);1144
(陆 彬)