(编者注:本资料摘自《超星数字图书馆》藏书;本文重点摘录药物微胶囊应用与发展、常用囊材与载体材料、工艺制作三个内容。工艺方面祗摘录了;相分离法、单凝聚法、复凝聚法、溶剂-非溶剂法四种,并且其中有些图片因复制不清而省略;标题是编者加的)
药物微囊化工艺——相分离法与单凝聚法
陆彬;药物新剂型与新技术,1998;171-177
一、相分离法
相分离工艺现已成为药物微囊化的主要工艺之一,它所用设备简单,高分子材料来源广泛,可将多种类别的药物微囊化。虽然已知界面大小、膜的多孔性、扭曲度、厚度与结构等对质量都有影响,但该工艺中仍涉及一些质量的问题未能作定量的研究并难于准确评价,如普遍存在的微囊或微球粘连、聚集问题(对明胶等亲水系统更为严重)。从已发表的论文看,相似的工艺得到的产品在粒径范围及释放数据方面有着很大的差异,这说明或者是工艺过程控制不严,或者是由于反应过分敏感,条件的微小变化可引起明显的效果差异。相图、微粒的形态学及膜结构的研究近来已更广泛和深人。
(一)分类 相分离法是在药物与材料的混合溶液中,加入另—种物质或不良溶剂,或采用其它适当手段使材料的溶解度降低,自溶液中产生一个新相(凝聚相),这种制备微粒的方法,称为相分离法,它可分为单凝聚法、复凝聚法、溶剂-非溶剂法和改变温度法。
(二)基本原理 单凝聚法系用一种高分子材料(如明胶或CAP)加人凝聚剂(降低溶解度)使之凝聚成囊或成球,这时凝聚相为高粘度、半流动的凝胶。凝聚是可逆的,解除凝聚的条件,就发生解凝聚而使微粒消失。制备时可利用这种可逆性反复操作育到得到满意的微粒后,便可固化定型。
复团聚法使用两种带相反电荷的高分子材料作为复合材料,如明胶与阿拉伯胶(或CMC或CAP等多糖)、海藻酸盐与聚赖氨酸、海藻酸盐与乙酰壳多糖、海藻酸与产蛋白、白蛋白与阿拉伯胶等。
现以明胶与阿拉伯胶为例,说明复凝聚法的基本原理。将溶液pH调至明胶的等电点以下使之带正电(pH4.0-4.5时明胶带的正电荷最多),而阿拉伯胶等仍带负电,由于电荷互相中和形成正、负离子的络合物,溶解度降低而凝聚成囊或成球。
在用单凝聚及复凝聚法得到满意的微粒之前,有时还需升高温度或加水稀释等,以提高凝聚物的亲水性,降低凝聚物的粘度,并提高界面张力,使微粒形状满意且可减少粘连,然后再固化。明胶常用醛类固化,CAP可加酸固化,海藻酸盐加CaCl2固化,蛋白质可加热或用醛固化。
溶剂/非溶剂法在材料溶液中加入一种对材料不溶的溶剂(非溶剂).引起相分离.而将药物包裹成囊或成球。药物可以是固体或液体,但必须对溶剂和非溶剂均不溶解。也不起反应。使用疏水材料,要用有机溶剂溶解,疏水的药物可与材料混合溶解,如药物是亲水的,不溶于有机溶剂.可混悬在材料溶液中。加入争夺有机溶剂的非溶剂使材料降低溶解度而从溶液中分离,形成囊膜或微球,过滤.除去有机溶剂即得微囊或微球。
相分离法涉及的机制包括;
1.界面能的降低、润湿与吸附 液态药物以乳化的状态分散,高分子材料起乳化剂作用,降低界面张力从而降低界面能,高分子材料被液态囊心物吸附。固态囊心物应与囊材有—定的亲和力,使凝聚相易于在囊心物面上润湿、吸附,为此,有时可加入润湿剂。
2.脱水(或脱溶剂)产生凝聚相 用于脱水的凝聚剂可以是乙醇、丙醇、异丙醇等强的亲水性有机溶剂,也可以是Na2SO4、(NH4) 2SO4、A12(SO4) 3等强的亲水性盐类.它们都能使高分子材料在水中的溶解度降低。
3.固化 根据高分子材料的化学性质,单凝聚通过加热或交联剂起化学反应固化定型(伴有收缩),复凝聚法形成正、负离子络合物凝聚再加交联剂固化,溶剂/非溶剂法在除去有机溶剂后,即固化成型。液态高分子可冻结成玻璃态或部分晶态。在凝胶中有自由水存在,高分子有较大的活动余地。凝胶失去溶剂可形成有粘弹性的膜附于囊心物界面上,膜经固化后产生巨大的应力,应力大过膜的抗拉强度,可能使膜形成裂口或孔隙.如膜的附着力小于应力,可在囊心物界面形成袋成空洞。固化过度又使膜易脆裂,故通常固化条件应加以控制。适当增大聚合物的Mav可以提高膜的抗拉强度,加入适当的增塑剂则可提高聚合物膜的柔顺性。增塑剂与形成膜的聚合物分子间应有较好的相容性,通常极性增塑剂(如酯、醚、羟基化合物)适用于极性聚合物(如纤维等衍生物、聚丙烯酸树脂类).非极性增塑剂(如烃类)适用于非极性聚合物(烃链聚合物)。

(三)工艺 相分离法制得的微囊一般粒径范围为2~250µm,取决于形成的囊心物的粒径及其分布与所用的工艺、亦可用相分离法制成载药的微球,或将药物用吸收或吸附的方法载入空白微球。
相分离法的基本工艺可归纳为三步:
1.在高分子材料溶液中,将药物溶解或分散成混悬液或乳状液。
2.相分离是靠降低温度、调节pH或加入脱水剂、非溶剂等凝聚剂.以降低高分子的溶解度、使高分子材料从溶液中析出,形成新的凝聚微球,或凝聚液相中的高分子沉积在囊心物上.并铺展成膜形成微囊,小的微囊也可嵌入大的微囊之中(图5-2)。
3.固化成微囊或微球。
事实上,以上三步不是绝对分离的,而是互相交叉的,在实际操作中由于三步速率的差异,其交叉的程度也不相同。加之药物及高分子的性质的差异,药物可以是液态或固态,固态药物可以是微粉化或未微粉化的,因而产品的粒径分布及形态可能是多种多样的,见图5-2。从微粒的碰撞及膜的凝聚过程出发,很容易理解这种多样性。碰撞可以发生在无膜的囊心物之间、无囊心物的空囊之间、空囊与微囊之间等;碰撞又可以发生在膜凝聚的初期、中期或后期,即膜的粘度逐步增大的全过程中;开始生成的微囊又可在不断搅拌的情况下再分散或再合并。这诸多的不同情况使可使微囊外形呈球形、椭圆形、不规则形或粘连形等;微囊可以是多囊粘连、囊中有囊、一囊多核、—囊单核、囊心物合并、囊与囊合并以及空囊等等。微球情况没有这么复杂,但也会出现合并、粘连、变形等。
二、单凝聚法
(一)制备工艺中的界面张力与附着力 单凝聚法的工艺中,将囊心物分散成微粉(或乳滴),其常用的囊材有明胶、CAP、EC、CMC、海藻酸盐等.加入凝聚剂使高分子囊材形成凝聚相,凝聚相应对囊心物有较大的附着力,否则微囊化难以完成。平衡时界面,几种界面张力γ的关系见图5-3,应有:
![]()
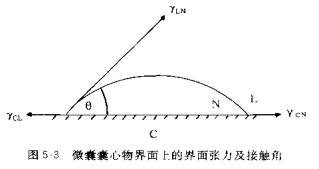
式(5-1)与第三章式(3-1)相似,只是脚标不同,脚标C表示囊心物,L表示溶液,y表示凝聚相。要凝聚相完全铺展在囊心物上的条件是;接触角θ=0°,或γCL≥γCN+γLN、实际上,只要凝聚相与囊心物有相当的亲和力,即使
90°>θ>0°凝聚相也会在囊心物回上润湿、铺展。当囊心物表面粗糙并升高温度时.由于界面能大而凝聚相粘度降低,被凝聚相润湿的囊心物面上的θ角会进一步降低。
在成囊系统中,—般只有药物、凝聚相和水三相。药物过分亲水则易被水包裹,只存在于水相中而不能混悬于凝聚相中成囊,如淀粉或硅胶作囊心物都因过分亲水而不能成囊。如药物过分疏水.因凝聚相中含大量的水,使药物既不能混悬于水相中,又不能混悬于凝聚相中,也不能成囊,如双炔失碳酯,但加入Span 20可增大双炔失碳酯的亲水性,就可以成囊。药物的亲水性适当,如非那西丁可包囊,但加入Tween80后,使药物亲水性过大.因此不能成囊。
表面张力很大的物质(γ>500mJ/m2)几乎可以被所有的液体润湿(降低界面能),也容易通过极性基团吸附蜡及油脂.而形成新的疏水表面。表面张力很小的物质一般都是疏水性的,不易被水润湿,包括大多数有机物和聚合物,而极性矿物质滑石粉及二氧化硅附着在界面张力很小的物质上时,可提高后者的可润湿性。活性炭很不易被四氢呋喃/环已烷中的聚丙烯酸酯衍生物所润湿(θ>90°),结果得到团块,使微囊化失败;聚异丁烯/四氢呋喃/环已烷中的聚丙烯酸酯衍生物则相反.能润湿活性炭,从而能制备活性炭微囊。
凝聚相与水相的界面张力应较小,使凝聚相可形成小的球状液滴,如CAP单凝聚时.用Na 2SO4作凝聚剂,成囊后凝聚相与水相的界面张力较大,囊形不好、需升高温度且加入水以降低界向张力,即可以改善囊形。又如明胶单凝聚成囊,需加入少许醋酸,使明胶含
[174]
有更多的-NH3+,增大凝聚相的亲水性,降低凝聚相与水相间的界面张力,即可改善囊形。
凝聚相应具有适当的流动性,这是保证囊形良好的首要条件。以上几例在降低界面张力的同时,也增大凝聚相的流动性。流动性与粘度呈反比,而粘度又是Mav的函数,通常Mav愈大在同样条件下粘度也愈大,粘度又随温度的增高而降低。CAP单凝聚成囊时需将温度控制在70-80℃,使凝聚相具有适当的流动性,以利成囊。如先将CAP按Mav分级,则Mav较低的CAP55℃即可成囊。
囊材聚合物在极性溶剂或非极性溶剂中都可被吸附。其吸附等温线(在一定温度下吸附量随吸附质浓度变化的曲线)在低浓度区上升很快,然后达到准平台区,再缓慢上升。准平台区相当于有几个分子厚的胶。由于聚合物的Mav分布较宽,其吸附等温线上升不象低分子物质(有折线),而是圆滑的。在不良溶剂中,聚合物的吸附量随其Mav的增大而升高,在良溶剂中则变化不显著,受温度影响不大,且吸附速率比低分子物质慢,也不易用稀释解吸。
(二)物理稳定性 微粒在放置过程中(特别是微粒混悬注射液中)会发生变形、粘连、聚集等不稳定的现象。现以单凝聚法制得的微囊注射液为例,介绍一种加速试验测定微球形态及粒径变化的方法[2]。
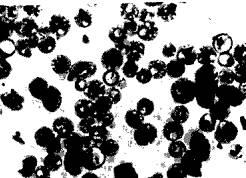
左炔诺孕酮(LNG)与雌二醇(E2)混匀,加到明胶溶液中混悬均匀,以硫酸钠溶液为凝聚剂制成微囊,形状见图5-4(a)。粒径在l0-40µm的占总重量的95%以上,平均体积径为20.7µm。
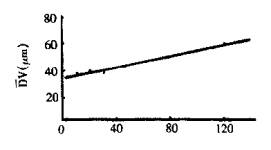
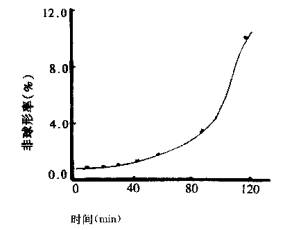
物理稳定性试验采用加速试验。取复方微囊混悬注射液l0支,置沸水浴中加热,每隔定时取一支,于光学显微镜下观察微囊外观,计数(球形数及非球形数),并求得球形微囊的体积径(Dv),得加热不同时间的平均体积径及非球形率,见图5-4(b)(c)。
由图5-4(b)可看出,平均体积径Dv随时间呈直线上升、由直线斜率得Dv变化速率=0.82%/分钟;由图5-4(c)可看出,加热至约90分钟时达到变形点(曲线两端切线的交点),微囊的非球形率开始明显上升,此时的粒径比原粒径增大74%、定为变形点,120分钟时非球形率已达10%,150分钟有晶体出现,且有的微囊已破裂。
上述微囊注射液分别于-4℃、37℃及室温放置,结果37℃的体积径变化速率=6.8%/月,达到变形点的时间为11个月,室温及-4℃达到变形点的时间约为9-10年,说明该微囊注射液可在室温长期贮存。
(三)实例
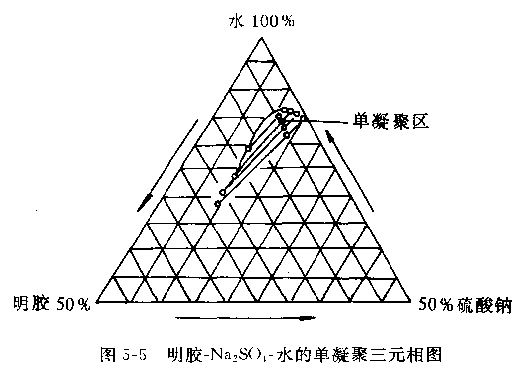
1.明胶为囊材 明胶-Na2SO4-水的单凝聚三元相图见图5-5。明胶为囊材的单凝聚法,可用于制备阿司匹林、磺胺噻唑、吲垛美辛、己酸羟孕酮、醋酸甲地孕酮、左炔诺孕酮、双炔失碳酯、戊酸雌二醇、雌二醇、液状石蜡、鱼肝油等药物。
工艺流程如下;将药物在30-50g/L明胶溶液中作成混悬液或O/W型乳状液→热至50℃→加稀醋酸调至pH 3.5-3.8→加入凝聚剂Na2SO4溶液得凝聚囊→加入稀释液*得沉降囊→冷至l 5℃以下加甲醛溶液→用NaOH溶液调至PH8-9,得固化囊(或在不宜用碱性介质时,可用戊二醛、丙酮醛等的中性溶液固化。) →用水洗至无甲醛得微囊。[注;*稀释液配法:稀释液即Na2SO4溶液,其浓度由凝聚囊系统中的Na2SO4浓度(如为a%)1.5%[得(a+1.5)%],所加体积为凝聚囊系统总体积的3倍,稀释液温度为15℃。所用稀释液浓度过高或过低,可使凝聚囊粘连成团或溶解。]
|
|
|
|
变化前 |
变化后 |
|
变化前后 |
|
|
|
|
|
微囊大小的变化曲线 |
非球形率的变化曲线 |
|
图5-4 复方左炔诺孕酮微囊注射液中微囊在沸水浴中的变化 |
|
明胶单凝聚法得的微囊见图5-4(a)的光镜变化前的图,对右炔诺孕酮、雌二醇的包封率分别为68.71%及74.85%。以SCMC为助悬剂、NaCl为等渗剂、醋酸苯汞为抑菌剂,制成供肌注的复方左炔诺孕酮/雌二醇(按5︰2重量比)微囊注射液,灌封于lml安瓶中,灭菌即得。注射液的热解活化能为134.4kj/mo1,说明化学稳定性高,体外溶出t1/2(左炔诺孕酮)
|
|
G
|
|
|
(a)左炔诺孕酮微囊(×100) |
|
|
|
(b)浓状石蜡微囊(×256) |
|
图5-6 明胶单凝聚微囊 |
研究表明,影响囊材单凝聚的主要因素是浓度、温度和电解质。浓度愈高愈易胶凝,太低不能胶凝;温度愈低愈易胶凝;浓度愈高.可胶凝的温度上限愈高;电解质中的阴离子对高分子的胶凝起主要作用:常见阴离子中.SO42-促进胶凝的作用最强,C1-次之,而SCN—则可阻止胶凝。低Mav明胶更容易从溶液中凝聚;当用硫酸钠作凝聚剂时,明胶溶液都容易凝聚,与pH值无关;当用有机溶剂(醇类及二氧六环)作凝聚剂时,碳链愈长的愈易引起凝聚(用量愈少);囊心物愈易溶于凝聚剂时,微囊化愈困难;囊心物与明胶凝聚相具有相反电荷的易微囊化;对无电荷的或与明胶凝聚相有相同电荷的囊心物,其微囊化的难易取决于明胶同囊心物的亲和力、亲和力强的或在微囊化发生之前囊心物已吸附大量明胶的,易被微褒化。
2.CAP为材料 以CAP为材料的单凝聚法,可用于制备硝硫氰胺、吲哚美辛等微球。制备硝硫氰胺微球的工艺流程如下:

将CAP溶于Na2HP04溶液形成CAP-Na→硝硫氰胺加少许Span20润湿后加入CAPNa溶液中→热至70℃-80 ℃加入凝聚剂Na2S04溶液凝聚成球→加以上成球系统总体积2-3倍的稀醋酸固化→用pH3-4的水洗至无Na2S04→得微球。
CAP单凝聚硝硫氰胺微球(图5—7)。
3.CMC作囊材 CMC作囊材单凝聚制备呋喃妥因微囊的工艺流程如下[3]:
将CMC溶于沸水中,冷至室温,加呋喃妥因成混悬液→搅拌下滴加A12(SO4) 3溶液,得凝聚囊→过滤,水洗,80 ℃干燥得微囊。
发现微囊粒径与释药速率关系很大,粒径大的微囊比界面减小,缓释明显。囊材︰囊心物为1︰l制得的微囊,粒径>840µm、476-840µm、247-476µm的在人工胃液中(括弧内为人工肠液中的)释药的t1/2,分别为193(20)分钟、68(<15=分钟、50(<l5=分钟。
4.海藻酸盐作囊材 在水溶液中制备水溶性不同的几种药物(布洛芬、茶碱、愈创木酚甘油醚、盐酸异ma黄碱)的海藻酸盐微囊,将药物0.51g溶于或混悬于海藻酸钠溶液中(100m1,含2g海藻酸钠,可加增塑剂),不要形成气泡、用注射器加到搅拌的40ml、l0g/L CaCl2中,1-2分钟后(搅拌时间太长则水溶性强的药物进入水相而降低载药量),将形成的凝胶微粒过滤,用水洗涤。60℃真空干燥12小时。药物的包封率一般在80%-98%范围内,载药量24.5%-29.4%。茶碱及盐酸异ma黄碱必须加入癸二酸二丁酯作增塑剂,否则聚合物凝胶易脆裂。释药速率同药物的水溶性、载药量等有关[4]。
参考文献
1.Brannon-Peppas
L.Int J. Pharm,1995,11 6,l
2.Bin Lu et a1.In Microencapsulation of Drugs ed.by whateley TL:Britain:Harwood Academic Publishers,1992.103-121
3.Ertan G,et a1.J Microencapsulation,1994,11(2),l 27
4.Bdmme r R and wang J.J Pharm Sci,1993,82(2),191