(编者注:本资料摘自《超星数字图书馆》藏书;本文重点摘录药物微胶囊应用与发展、常用囊材与载体材料、工艺制作三个内容。工艺方面祗摘录了;相分离法、单凝聚法、复凝聚法、溶剂-非溶剂法四种,并且其中有些图片因复制不清而省略;标题是编者加的)
药物微囊化工艺——复凝聚法与溶剂-非溶剂法
陆彬;药物新剂型与新技术,1998;177-183
三、复凝聚法
复凝聚法利用两种有相反电荷的高分子材料,互相交联形成复合囊材自溶液中析出(可将药物包裹在内)。如用明胶及阿拉伯胶为材料.介质水、明胶、阿拉伯胶三者的组成与凝聚现象的关系可由图5-8三元相图说明。图中K为复凝聚区,即可形成微囊的低浓度明胶和阿拉伯胶混合溶液;P为曲线以下两相分离区,两胶溶液不能混溶亦不能形成微囊;H为曲线以上两胶溶液可混溶形成均相的溶液区。A点代表10%明胶、10%阿拉伯胶和80%水的混合液,必须加水稀释,沿A→B虚线进入凝聚区K才能发生凝聚。
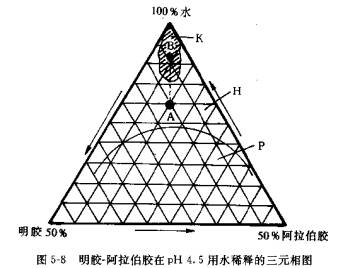
相图说明,明胶同阿拉伯胶发生复凝聚时,除pH值为主要条件外,浓度也是重要条件。
以明胶-阿拉伯胶为囊材的复凝聚法工艺流程如下:
将固态或液态药物与25-50g/L明胶和25-50g/L阿拉伯胶溶液混合,得混悬液或O/w型乳状液→在50-55℃加入50g/L醋酸到pH 4.0-4.5、形成凝聚囊→用成囊系统体积1-3倍的30-40℃的水稀释,降低界面张力得沉降囊→在10℃以下加入甲醛溶液,用200g/L NaOH调至pH 8-9,得固化囊→水洗至无甲醛,得微囊。例如左炔诺孕酮和戊酸雌二醇微囊和氯贝丁酯微囊,分别见图5-9(a)[5]、(b)。
阿司匹林的明胶-阿拉伯胶复凝聚微褒在用甲醛固化后,经冷冻干燥得微囊粉,粒径多数在2-50µm,平均收率可达91.4%[6]。也有人在制备明胶-阿拉伯胶复凝聚微囊时,加入聚丙烯酸树脂作致密剂,减少囊膜的孔隙,较好地解决了微囊漏药问题[7];在包封冰片时,发现冰片吸附阿拉伯胶比吸附明胶牢固,故先用阿拉伯胶与冰片制成初乳,后加明胶形成囊膜再交联,效果较好[8]。
明胶-阿拉伯胶复凝聚微囊可用水溶性的碳二亚胺修饰其表面的羧基使羧基活化,用来与聚丙烯酸树脂连接,使微囊表面性质改变,增强与胃粘液的粘附性,提高微囊中药物的生物有效性和疗效。用复凝聚法制得花生油明胶-阿拉伯胶微囊(用戊二醛固化)后,先用1-(3-二甲氨丙基)-3-乙基-碳二亚肢(EDC,作交联剂,形成酰胺键),与14C-甘氨酸乙酯与醋酸钠反应,分别测定微囊表面的羧基密度和氨基密度。微囊上羧基的测定反应式如下(Wn表示微囊):
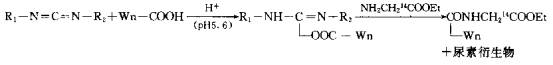
|
|
|
|
(a)左炔诺酮/戊酸雌二醇微囊 |
图5-9 明胶-阿拉伯胶复凝聚微囊(×100) |
发现由于与戊二醛交联使微囊的氨基减少。将空白微囊与聚丙烯酸树脂结合后,羧基增加了67%(最佳比例为微囊︰聚丙烯酸树脂质量比约6︰1).体外试验中使空白微囊对粘液的粘附得以改善”。
海藻酸盐、CAP和SCMC等多聚糖化合物,同阿拉伯胶一样都含有-COOH、-COO-,是带负电荷的高分子材料,均能用作与明胶复凝聚制备微囊的囊材。此外,明胶、邻苯二甲基化明胶、明胶-乙酰甲基醚马来酐共聚物、明胶-乙酰马来酐共聚物也常用作复凝聚法的复合囊材,最近也有用脱乙酰壳多糖-海藻酸盐或海藻酸盐-聚赖氨酸作复凝聚法复合囊材的。
制备白蛋白的脱乙酰壳多糖(CTS)-海藻酸盐微囊,在10g/L醋酸溶液中加入不同量的CTS 制成1-48g/LCTS溶液,放置4小时,过尼龙膜除去固体粒子,取部分滤液加入NaNO2,达到NaN02/CTS的摩尔比为0.05︰1,放置过夜(目的是降低CTS的Mav)。使氧化断键的反应完全,CTS的Mav由原来的1.25×l06。降到0. 25×l06。分别取此低Mav的CTS溶液及另一部分Mav末变的CTS溶液、加入CaCl2达1.5%,搅拌2分钟以上:使完全溶解,用NaOH溶液调至pH5.5,此混合液称为包囊液,用于以下包裹(对两种Mav的CTS操作相同)。在l 5-25g/L海藻酸钠的生理盐水溶液中,加入小牛血清白蛋白BSA使其干重与溶液中海藻酸钠干重相等。用10ml空针筒盛15g/L海藻酸钠溶液10m1,配以22号针头,用空气加压,使其流出的速率达32.0ml/h,在液面上6cm处射向50ml搅拌中的包囊液(搅拌桨恰在射入的液滴下),反应10-45分钟。这样可制得粒径500-600µm的微囊,用生理盐水洗涤备用。对照组为不含BSA的或含BSA但无CTS的微囊,它们由15g/L、20g/L、25g/L海藻酸钠制备。发现反应时间l0-45分钟对BSA的释放无影响;增大海藻酸盐浓度会降低释放BSA的速率(4小时时,15g/L海藻酸盐的释放37%,而25g/L的释放20%);低Mav的CTS制得的微囊释放较快(4小时,77%),未降低Mav的制得的微囊释放较慢(4小时,37%),由高Mav的CTS制得的微囊续释较好(t1/2约8小时),由高低Mav混合物制得的微囊缓释最显著:开始4小时仅释放20%,24小时时共释放44%;释放介质的pH增大会加快释放(24小时时,pH3.0时释放15%,pH8.0时释放73%,因前者膜的膨胀较慢),表明口服时在胃液中缓择明显,而在肠液中释放较快[10]。
研究了用白蛋白-海藻酸复凝聚制备蛋白质微囊,由于其复凝聚的浓度范围很窄,且凝聚物很粘稠,认为不宜用于微囊化。白蛋白-阿拉伯胶(在pH3.9,离子强度1mmo1/L时)分别带正电荷和负电荷,且电荷量相等,此pH称为电当量pH(electrical equivalence pH,EEP);离子强度增大,二者电势的绝对值都降低,pH3.9时离子强度为10mmol/L复凝聚的产率最高(89%,对1%的1︰1混合物);由于在pH3.9时迅速分离出粘度很大的凝聚相(粘度比明胶-阿拉伯胶复凝聚系统在最高产率时大3个数量级).不宜用于制备,在接近最高产率的条件下,如离子强度l0mmol/L、pH4.2时,为乳白色分散系统,制得的复凝聚微囊不经戊二醛交联也不加热,可稳定46天[11]。
采用学凝聚或复凝聚法制备微囊,要求固态或液态药物的表面可被囊材凝聚物所润湿,从而使药物混悬或乳化于该凝聚物中才能随凝聚物分散成囊,有时需根据药物性质加入适当的润湿剂。
四、溶剂-非溶剂法
在聚合物溶液中,加入一种对该聚合物不溶的液体(称非溶剂),引起相分离而将药物包成微囊或形成微球,称为溶剂-非溶剂法。本法药物可以是水溶性或亲水性的固态或液态药物,但必须对聚合物的溶剂与非溶剂均不溶解,也不起反应。
(二)应用实例
1、地西泮(即安定)微囊 分别用乙基纤维素(EC)或明胶为材料制备微囊。将地西泮分散在40g Ec儿丙酮溶液中,再在液状石蜡中分散成O/O型乳状液,加蒸馏水(非溶剂)使EC凝聚成囊,洗涤、干燥,得EC微囊,其载药量大,释药较慢。另将地西泮分散在明胶水溶液中,用液状石蜡形成w/o型乳状掖,加异丙醇(非溶剂)脱水,洗涤得微囊。所得两种微囊均为球形、易流动粉末,不粘连。50%-60%的粒径在500-840µm范围,随囊材/囊心物比值的增大,载药量降低,释药的t1/2则增大。
2、促肝细胞生长素微球 将该药物的浓液在液状石蜡中与乳化剂及CAP(丙酮/乙醇溶解)搅拌乳化,加入氯仿(非溶剂)固化后,离心、用乙醚洗涤、干燥,即得类白色粉末状微球,放大照片见图5-12。微球平均粒径12.7µm,载药量29.7%,包封率95.7%。
3、 布洛芬微球 控制释药的布格芬Eudragit RS海绵状微球可用溶剂-非溶剂法制得。每份2.5g布洛芬与0.833g Eudragit RS加不同量(3mL、5m1、8m1、10mI)乙醇制得浓度不同的溶液,将乙醇溶液倒人200ml 0.25g/L的蔗糖脂肪酸酯的25℃水(非溶剂)溶液中搅拌成球(300 r/min)30分钟,过滤,减压干燥24小时,过筛得250-1410µm微球。微球具有海绵状结构,溶解特性和压缩特性都与一般的微球或微囊不同。改变乙醇溶液的浓度,可以改变微球内部的多孔性:浓度低时孔隙可高达微球体积的50%。微球的释药速率符合Higuchi方程,在粒径和载药量—定时,释药速率仅取决于其内部的多孔性的程度。微球的可压缩性大,愈多孔的微球,制得的片剂愈坚实[13]。
4、 氟脲嘧啶微球 用DL-丙交酯/乙交酯共聚物[P(DL)LG]为载体材料,以溶剂-非溶剂法制备5-氟氟脲嘧啶 (5-Fu)微球时,将1.0g 5-Fu混悬于含10g/L P(DL)LG和适量Span80的30m1氯仿溶液中,在800 r/min匀速搅拌下缓缓滴加非溶剂70ml石油醚(氯仿不断挥发),待微球生成后再加70m1石油醚固化,收集微球,室温下减压干燥过筛,得70%以上粒径范围为105-180µm的载药微球,载药量57%-59%。微球在pH7.4的磷酸缓冲液中的体外释放t1/2(2.3小时)约比原药5-Fu延长1倍,微球的样药主要是通过扩散进行的[14]。
参考文献
5刘础,陆彬.中国医药工业杂志,1994.25(11):494
6.孙容波等.中国医院药学杂志,1991,11(10):461
7.汪国华等.中国医院药学杂志,1993.13(3);126
8.马树人,何雁.中成药,1992,14(3):2
9. Whareley TL.Microencapsulation of Drugs Britain; Harwood Acadermic
Pblishers,1992,65-80
10.Polk A,et a1.J Pharm Sci,1994,83(2):178
11.Burgess KK
and Singh 0N.J Pharm
Pharmacol,1993,45;586
12.Donbrow M. et
al.J
Microencapsulation,1990,7;1
13.Kawashima Y,et a1.Chem Pharm
Bull,1992,40(1)196
l4.沈正荣等.现代应用药学,1993,10(3);14

